韩春雨事件后 河北科技大学等科研管理机构何去何从
来源:新浪科技 2016-11-17
编者按
2016年5月2日,来自河北科技大学副教授韩春雨实验室的论文《利用NgAgo进行DNA引导的基因组编辑》发表于《自然-生物技术》,就此在中国学术界和公众领域掀起了一场轩然大波。数月以来,国内外数十位科学家在自媒体和公共媒体上对这项技术的态度从最初的欢迎转变为质疑;过去一周,《细胞研究》和《蛋白与细胞》两个遵循同行评议的专业学术期刊先后发表论文,报道了中外数十个研究组无法重复NgAgo的基因组编辑结果。据悉,《自然-生物技术》也将在近期刊发相关通讯文章。
我们很高兴地看到,学术界具有强大的自身净化能力。特别是在新媒体时代,富有专业精神和严肃态度的科学家们可以及时将最新科技进展在公共层面进行展示、质疑、和讨论。然而,我们也深深地感到遗憾,在同行实名质疑四起之时,河北科技大学作为该论文的通讯单位却没有按照我国基金委、科技部、教育部屡次三番强调的学术准则开展任何调查。一个国家、一个单位的学术声誉不仅仅是由学术成果构建,还体现在应对学术质疑的态度是否符合国际学术道德规范。我们再次敦促河北科技大学等国内有关科研管理机构针对韩春雨博士的NgAgo论文展开专业化调查。我们预见:针对已经成为社会公众事件的NgAgo论文的调查方式和调查结果将对中国的学术道德建设和科研文化产生重大和深远的影响。
Protein & Cell 编辑部评论
NgAgo: 希望还是失望?
2016年11月16日,《蛋白质与细胞》(Protein& Cell)期刊在线发表了一篇由国内外21个课题组联合发表的题为《有关NgAgo的疑问》(Questions about NgAgo)的学术论文,报道多个实验室均无法重复韩春雨的NgAgo基因编辑新技术。同期还配发了编辑部的评论《NgAgo:希望还是失望?》(NgAgo: A Hope or A Hype?)。
评论首先回顾了基因编辑技术的发展历史。长久以来,生物医学研究领域的科学家们一直在坚持不懈地寻找一种方法,在特定细胞或者生物体内精确修改遗传信息。这种方法一般称为“基因编辑”或者“基因组编辑”,无论是在科学研究方面还是在医疗应用方面,基因编辑技术都展示出了诱人的价值和潜力。上世纪60年代,限制性酶的发现导致了重组DNA技术的诞生,开创了现代生物技术。而近些年来,TALEN和CRISPR技术的发展,更是开创了基因组编辑时代,成为了当今最有希望应用于临床医学治疗的基因编辑技术之一。
尽管我们目睹了这些令人振奋的成就,但是基因组编辑技术的进一步发展仍然存在着巨大的挑战,特别是在提高编辑效率和消除脱靶效应方面。 2016年5月,高峰等研究者在《自然-生物技术》(Nature Biotechnology)上发表论文报道,古细菌来源的一种DNA核酸酶(NgAgo)能以DNA寡核苷酸引导的方式精确地识别和有效地编辑哺乳动物细胞的基因组DNA。鉴于研究人员对新的基因组编辑工具的渴望,这篇论文立刻引起了强烈的关注,并在科学界产生了广泛的影响。例如,有人认为,NgAgo可以作为一个重要的甚至更优的方法替代CRISPR系统,因为后者的基因编辑功能需要短序列的RNA。
然而,最初几个月的兴奋之后,关于NgAgo基因组编辑技术可重复性的争议日益积累,很多在线科学论坛都出现了质疑的声音,报道NgAgo的基因组编辑能力不像其原始论文报告的那样有效。此外,国内外研究人员已经开始公开或私下地讨论他们不能重复出高峰等人的关键结果。由于NgAgo基因组编辑技术的持续争议,《蛋白质和细胞》决定在本期发表一篇学术短文,由来自多个机构的20个独立研究组联合撰写并提供了有关数据,反驳了韩春雨文章的最初报告。在这篇通信中,作者们表明,NgAgo在一系列实验条件下对哺乳动物细胞的基因组DNA没有编辑活性。《蛋白质与细胞》指出,尽管围绕着NgAgo技术的争议已经发酵了几个月,但大多数批评没有以正式和学术的方式提出,特别是没有发表在同行评议的科学杂志上,这大大限制了科学共同体对双方论点的客观评估。因此,《蛋白质与细胞》相信并希望这些相互矛盾的结果的发表,可以提醒科学共同体重新审视NgAgo,并有助于基因组编辑技术的发展。
简介:Protein & Cell 通信论文
有关NgAgo的疑问
来自18个研究机构的20名科学家对NgAgo提出了质疑。2016年5月,《自然-生物技术》发表了韩春雨组的论文,报道使用NgAgo蛋白可以在哺乳动物细胞基因组上47个位点100%进行基因编辑,效率为21.3%—41.3%。《有关NgAgo的疑问》的作者们在多种细胞系、小鼠和斑马鱼等模式生物上实验NgAgo的基因编辑功能,在大多数情况下,使用了密码子优化的NgAgo和类似CRISPR/Cas9的实验方法,然而在全部实验中,NgAgo都不能进行基因编辑。接着,部分作者转而使用该文通讯作者韩春雨使用过的NgAgo表达载体进行实验,该载体或者直接来自于韩春雨研究组,或者来自于韩春雨提供给Addgene的载体。出乎意料的是,更改载体仍然不能进行基因编辑,因此作者们直接对韩春雨组论文图4的实验进行重复。来自8个不同实验室的代表性结果(本文图1)显示,严格按照高峰等论文的实验流程以及韩春雨在Addgene网站更改的流程,用T7E1体系直接重复高峰等论文图4的相同位点,都看不到基因组编辑的结果。此外,本文的补充数据展示了大量来自不同实验室的尝试,分别在和高峰等论文相同或者不同的细胞系、模式生物中使用了NgAgo进行基因编辑,结果均为阴性。
韩春雨对公众说,NgAgo实验需要“高超的实验技巧”,而且做NgAgo实验需要先重复出来图3c。图3c是向细胞系转染NgAgo和靶向GFP的gDNA。作者们证实确实能看到GFP表达下降,但是无法证实这是DNA突变引起的,因为很多因素都能影响GFP的表达,比如NgAgo影响RNA或者转染造成的非特异的细胞胁迫状态。针对韩春雨最近表示NgAgo的活性对于细胞污染非常敏感,作者们表示,一方面不可能所有的独立实验室都出现细胞污染,另一方面部分实验室再次重复韩春雨的实验前,已经进行了检测并排除了支原体污染。
作者强调,韩春雨论文的关键点是用NgAgo在47个位点能进行100%的基因编辑,效率最低是21%。韩春雨组论文提供的实验流程和他在Addgene提交的修改后流程,都没有提到“高超的实验技巧”。部分作者为了搞清楚原因,向韩春雨实验室派出了客座研究人员,但是在韩春雨的实验室,他们没能获得允许在其实验室中进行哺乳动物细胞基因组编辑实验。因此这些研究人员当面访问韩春雨的实验室后,并没有获得有效信息。
本文图1意在重复韩春雨组论文的图4,使用了和原论文相同的293细胞系和基因位点DYRK1A以及其他一些位点,严格按照韩春雨原始论文的实验流程或者其提交给Addgene的修改版流程,细胞经过检测没有支原体污染,gDNA的磷酸化通过公司合成或者实验室添加。T7E1实验证明,在测试的位点均没有基因编辑。
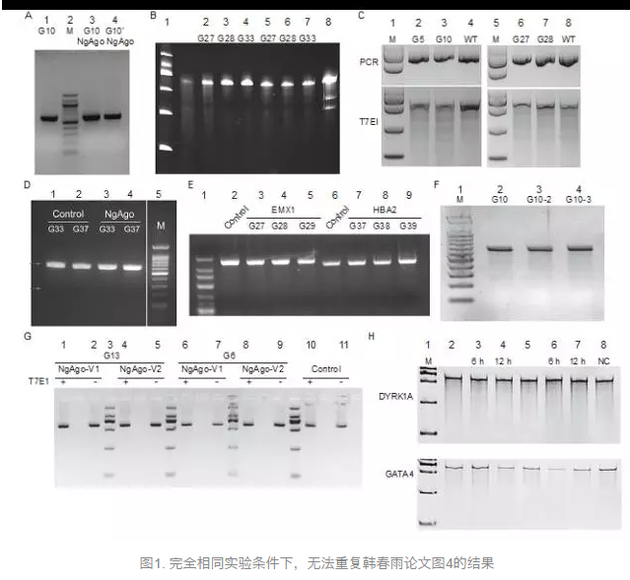
在本文的补充数据部分,有更多数据分别报道了各自实验室在相同体系中重复韩春雨的实验、或在不同体系中扩展韩春雨实验的结果,NgAgo均不能进行基因编辑。
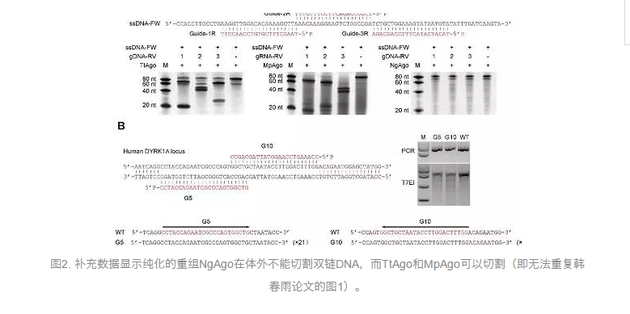
其中,来自中科院动物所李伟实验室的结果显示,用纯化的重组NgAgo蛋白,在37摄氏度和高温(50度和75度),都不能在体外切割双链DNA,而作为对照的TtAgo和MpAgo(已经被2014年荷兰实验室《自然》论文报道)则能在高温下进行DNA切割。
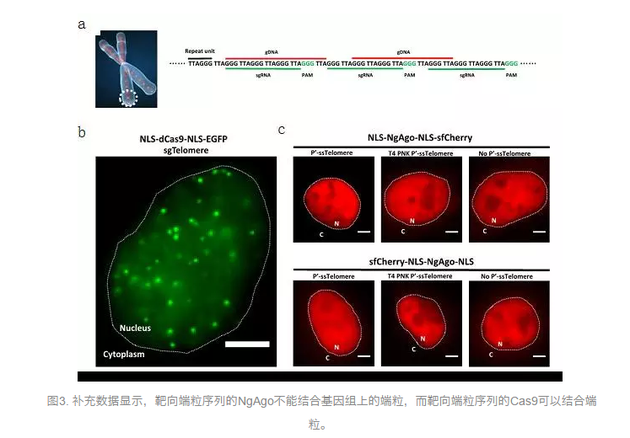
黄军就、杨辉、李劲松、周斌等实验室则分别报道,NgAgo不能在小鼠胚胎中切割基因组。孙育杰实验室报道,通过光学成像,NgAgo不能结合在基因组端粒上。熊敬维实验室则报道,NgAgo不能在斑马鱼胚胎中切割基因组DNA。
在这篇通信中,作者们还指出,网络论坛上有一些非正式的、支持韩春雨实验结论的讨论;另外,韩春雨引用《自然》的新闻报道作为自己实验能被重复的证据。这更引起科研人员的困惑,因为网络上的言论和新闻报道并不能被更广泛的科学共同体获取。因此作者们要求原始论文的作者,包括韩春雨,澄清围绕NgAgo的不确定结论,提供全部实验细节以重复其实验。
注:《蛋白质与细胞》(Protein & Cell)是由高等教育出版社、北京生命科学院和中国生物物理学会联合创办的综合性学术期刊,报道生命科学和生物医学的前沿热点,特别关注蛋白质和细胞研究的最新学术成果和发展动向,由清华大学教授饶子和院士担任主编,北京生科院院长康乐院士、副院长高福院士、蛋白质科学国家实验室主任许瑞明研究员担任副主编,旨在为全球生命科学领域的研究人员提供一个严谨而开放的学术交流平台,自2010年创刊以来国际影响力日益提升,目前已经成为我国生命科学旗舰期刊之一。
-

韩春雨事件后 河北科技大学等科研管理机构何去何从
-

-





























