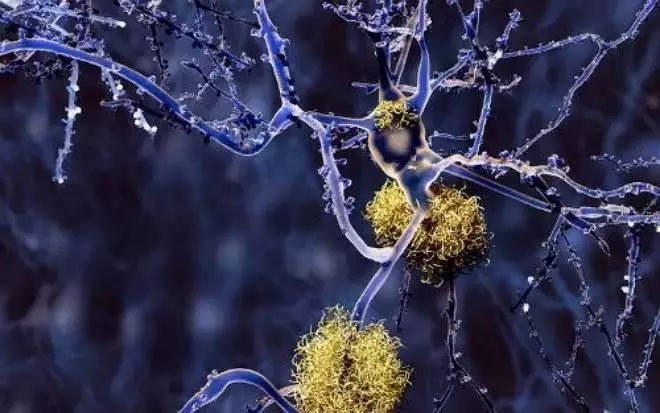
淀粉样蛋白是由数千种蛋白质紧密结合在一起堆叠而成的聚集体,淀粉样蛋白的形成与几种广泛性疾病有关,包括阿尔茨海默氏症和II型糖尿病。现在发表在《化学物理》期刊上的研究中,科学家们报告了淀粉样纤维形成的数学模型。这个模型揭示了聚合过程是如何以催化的方式发生,这是以前没有很好理解的事情。研究人员将模型应用于一种与阿尔茨海默氏症相关的特定蛋白质Aβ40聚集。
结果表明,Aβ40纤维的聚集过程通常发生在界面处,如靠近液体溶液表面或试管的玻璃壁。这对解释阿尔茨海默氏症和其他疾病研究中使用的实验室数据具有重要意义。该模型由一组数学方程组成,称为速率方程,描述了蛋白质聚集浓度随时间的变化。模型中的每个反应步骤都被证明与涉及酶反应中的步骤相似。酶的作用是通过生长纤维尖端或侧面,或者可能是反应容器的表面来起作用。
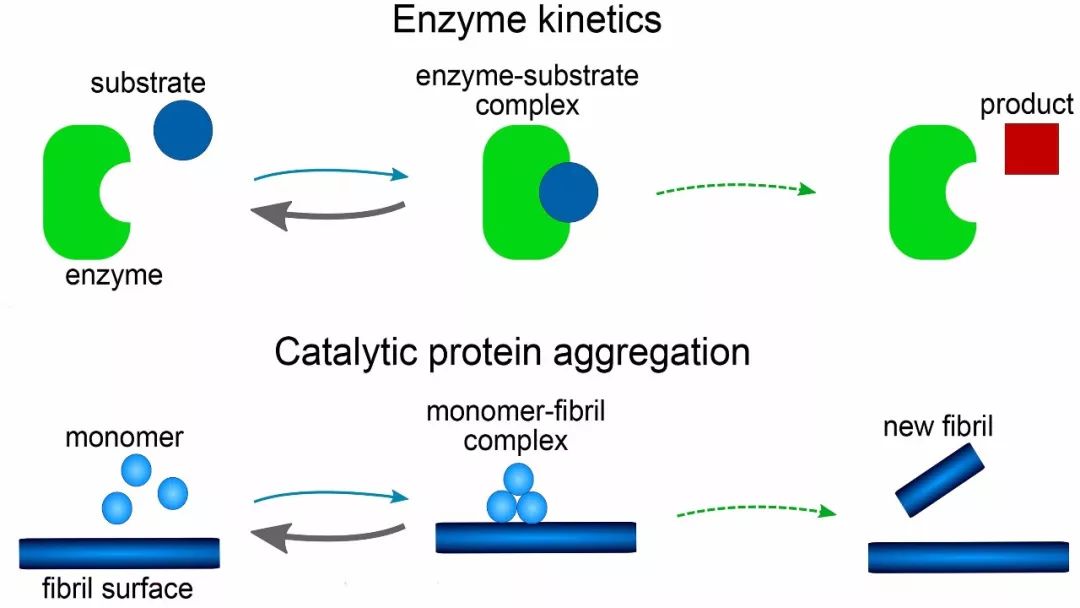
研究人员发现,模型的数学形式与1913年首次发表的描述酶反应速率的著名米氏方程有关。数学形式比以前所有用于淀粉样蛋白形成的模型都要简单得多,而且还有一个额外的优势,那就是方程可以手工求解,而不需要计算机模拟。合著者Alexander Dear说:我们希望这篇论文开发的方法论,将支持未来对新淀粉样蛋白形成现象进行建模的努力。为Michaelis-Menten型方程找到的数学解。
关键特征之一是一种称为饱和的现象。当饱和发生时,在高蛋白浓度时,催化位置会被完全占据。在Aβ40研究的情况下,饱和度还表明,引发聚集的过程涉及到表面,如试管的壁。虽然这些结论并不直接适用于身体本身,但合著者Tuoma Knowles说:这项研究工作将是促进在体液中发现其他物种的情况下,淀粉样蛋白形成的研究核心。研究还将实验数据的分析带到了一个新水平,这对于获得有效的淀粉样蛋白形成抑制剂将必不可少。

由可溶性多肽形成的淀粉样纤维,是许多神经退行性疾病的标志,如阿尔茨海默氏症和帕金森氏病。表征这些现象背后的微观反应过程有助于洞察此类疾病的发展,并可能为设计阻止这些疾病的药物提供合理方法。实验证据表明,大多数这些反应过程本质上是催化的,在生物系统典型条件下可能会表现出类似酶的饱和效应,但目前还缺乏一个统一的模型框架来解释这些饱和效应。因此,本研究提出了一个生物纤维形成的通用动力学模型。
在该模型中,反应网络中的每个基本过程都可以被催化。所导出的单一封闭形式表达式,能够高精度地描述广泛的生物丝形成机理,并提供其中多个反应过程饱和的体系的第一积分速率定律。此外,其前所未有的数学简单性使研究人员能够非常清楚地解释饱和度增加对整体动力学的影响。通过对Aβ40体外聚集数据的拟合,说明了该模型的有效性。值得注意的是,研究发现一次成核变得饱和,表明它一定是非均相的,发生在界面上,而不是在溶液中。
博科园|研究/来自:美国物理研究所
参考期刊《化学物理》
DOI: 10.1063/1.5133635
博科园|科学、科技、科研、科普



 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国
