作者: Yuki、Nekout
编辑:kamin
“你们做不出来。”
当得知大洋彼岸的中国,有个名不见经传的小团队要尝试鉴定朊病毒,美国酵母朊病毒鉴定的顶级专家兰德尔·哈尔夫曼(Randal Halfmann)这样评价。
然而,就在前天,2019年1月21日,这个团队的研究成果:《一种病毒编码的朊病毒》(A viral expression factor behaves as a prion)发表在《自然-通讯》杂志上 [1] 。

这一研究, 将朊病毒的发现历程从动物、植物、真菌、细菌扩展到了最后一种生命形式——病毒 。同时,可能为揭示病毒感染和阿尔兹海默症之间的必然联系带来新的启示。
这是中国第一个成功在朊病毒鉴定领域开拓疆土的团队,它的成员总共只有三人: 许晓东、陈红英和南昊 。

(这项研究的发起者,许晓东副教授。图片来源:南昊)
蛋白胶上的“异常信号”
时间回到2002年,许晓东刚从中科院微生物所来到英国雷丁大学,跟随著名病毒学教授伊恩·琼斯(Ian Jones)读博士。当时他的课题是研究昆虫杆状病毒中几种晚期表达因子。
那时候,蛋白的研究手段还没有现在这么丰富。为了研究这些晚期表达因子的功能特征,许晓东开始尝试分别在昆虫细胞和大肠杆菌中,重组表达这些蛋白。而为了检测蛋白表达蛋白是否成功、表达蛋白的产量多少,就需要用到一套电泳+免疫印迹检测方法。
这个过程,就好像是让细胞中所有的蛋白进行一场“游泳比赛”。由于这些蛋白原本形状不一、电荷各异,会影响到比赛结果。因此需要先加入特殊试剂煮沸样品,剥夺其形状,覆盖其电荷,让它们变成统一直径、穿着“等身负电荷泳装”的“圆棒”。这样,它们在游泳池——聚丙烯酰胺凝胶电泳(SDS-PAGE)中的游速,就只和各自体重(分子量大小)有关了。
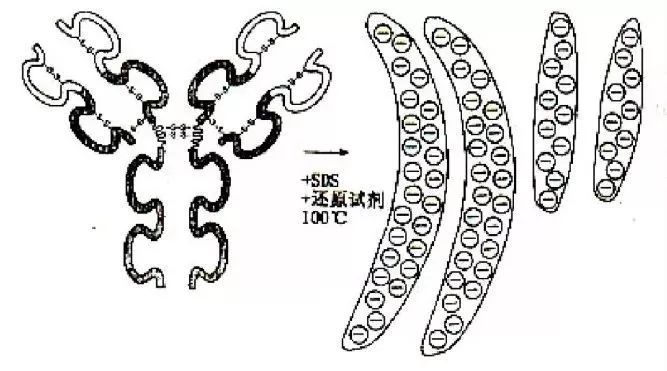
(蛋白质样品在100℃用SDS处理后变为带电荷的“圆棒”)
电泳凝胶的设计可谓十分精妙,它分为上下两层,通电后,上层的浓缩胶会让排队进场的蛋白队员们“纵列变横列”,汇集于泳道前站成一排做好准备。等进入下层的分离胶,就像听到一声哨响,不同分子量的蛋白开始各自发力向终点(电泳槽正极)游动。
质量小的蛋白受到的阻力小,游得快;质量大的蛋白受到的阻力大,游得慢。“游泳比赛”结束后,通过后续检测,就可以大致得知某种特定的蛋白含量究竟有多少了。
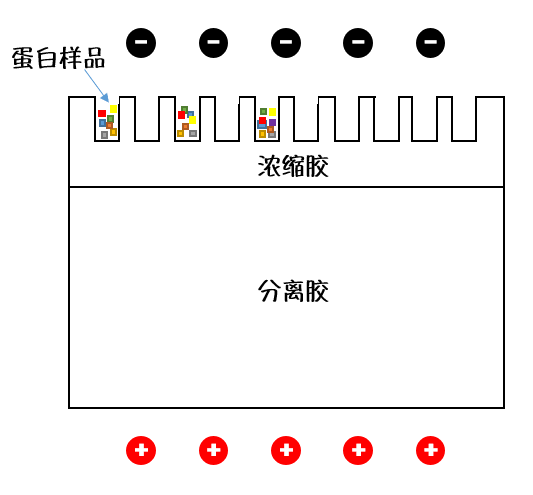
(蛋白电泳用到的凝胶(示意图)。 Nekout绘制。)
通常来讲,前期处理蛋白用到的试剂(SDS和巯基乙醇)会拆开所有聚合的蛋白,浓缩胶中是不会再留有蛋白的。所以,大家 一般都会直接把它切下来丢掉 ,只检测分离胶的部分。
而彼时,刚到英国第一次接触这个操作的许晓东,对这套流程显然尚不熟悉,误打误撞将浓缩胶也一并做了检测。检测过程中,他意外地发现了一种奇怪的现象:他的样品中, 一个名为LEF-10的杆状病毒晚期表达因子出现在了浓缩胶里,并且信号非常强烈 。

(LEF-10出现在浓缩胶中(示意图)。 Nekout绘制。)
若将这一现象讲给一位蛋白试验高手,那么多半他的第一反应是“样品加的太多啦,蛋白变性不彻底”。还是新手的许晓东,也怀疑这是自己操作的bug。
为了解决这个问题,他不停调整试验方法,奇怪的是, 无论怎么调整,LEF-10蛋白都雷打不动地“赖”在浓缩胶里不走 。这个现象引起了许晓东极大的好奇。
许晓东有个好习惯,但凡遇到不明白的事情,就立刻去查找资料,甚至穷尽文献,直到获得令他满意的解答为止。但是这一回, 他遍历了图书馆的相关书籍和期刊文献,却没有找到任何相关记录 。
他又将这一现象汇报给导师,向导师请教。但他的导师刚刚申请到HIV相关的课题,对他那块“奇怪的浓缩胶”并不怎么感冒。没有导师的支持,这一发现就此被选择性的“忽略”了。
不过, 从那时起,浓缩胶里的异常信号,就一直萦绕在许晓东心头 。
在黑暗中缓慢前行
2009年,许晓东和妻子陈红英回到中国,他想找一个可以远离城市的地方安静做科研,于是选择了去西北农林科技大学生命科学学院任教。
夫妻二人共同建立起实验室,也逐渐展开新的课题研究。
最让许晓东惦记的,仍然是浓缩胶里的LEF-10。他一心想搞明白那个异常信号到底代表着什么。从英国到中国,他几乎逢人就问,不放过一丝线索。他带过的历届学生,也都知道他的这个心结。
不论怎么问,许晓东听到的答复始终是“没见过”、“不知道”。而越是这样,他做下去的决心就越坚定。
对于科研,许晓东一直坚信这样一个理念: 好的课题,不能仅仅着眼于局部,而是要立意高远,必须有生物学上的普遍意义 。
他隐约感觉到,这个异常信号的背后一定蕴藏着某些特别的含义。而他的目标,就是无论如何也要找到其中隐藏的秘密。
不过,由于没有任何可借鉴的先例,许晓东在研究初期完全找不到头绪。他带着自己的学生在黑暗中探路,一条行不通,就换另一条,反反复复尝试,断断续续摸索,进度异常缓慢。
经过很长一段时间的努力,许晓东总算收集到一些关于LEF-10的重要线索。
线索一:聚合体分子量大且不均一
纯化后的LEF-10蛋白,会形成大分子聚合体 。许晓东通过分子量排阻色谱(一种检测物质分子质量的方法)发现 ,LEF-10形成的聚合体并不是“统一规格”的,而是分子量不均一的聚合体“集合”。
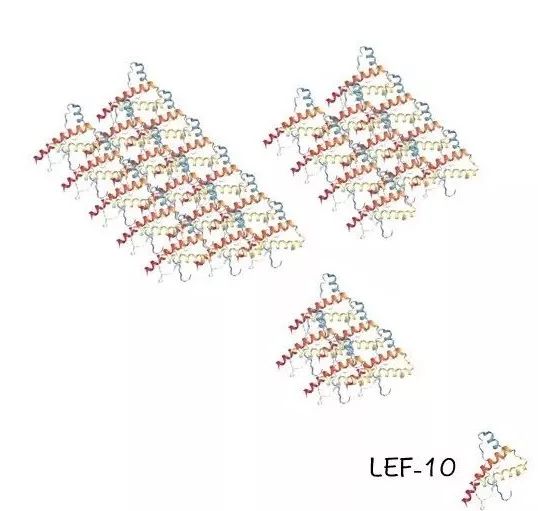
(LEF-10聚合体分子量大且不均一(示意图)。Nekout绘制。)
线索二:聚合体常带有DNA
既然是聚合物,那么就有必要搞清楚它是由什么聚合在一起的:到底是单纯的LEF-10蛋白?还是有其他的生物大分子参与?通过酚氯仿抽提,许晓东竟然从聚合体中获得了DNA。

(聚合体常带有DNA(示意图)。 Nekout绘制。)
线 索三:截短体27-78形成的聚合体分子量呈现严格的倍数关系
DNA结合特性使LEF-10的研究变得复杂。许晓东便尝试将这个蛋白截短,去掉能与DNA结合的那些氨基酸,看它是否还能形成聚合体。测试过多种类型的截短体后,他们发现当保留第27位到第78位氨基酸的部分时,该蛋白不再带有DNA,但不影响聚合能力。更重要的是, 这些聚合体按分子量呈现出了漂亮的倍数梯度 。

(截短体27-78形成的聚合体分子量呈现严格的倍数关系。Nekout绘制。)
线索四:LEF-10仅在少量细胞中表现为聚合体形式
后来,许晓东又将绿色荧光蛋白融合在了LEF-10蛋白上,观察LEF-10在原生细胞中到底是什么样子。他发现, LEF-10在极少量的细胞中能形成有较强荧光信号的斑点 。而大部分的细胞中LEF-10都是均匀分布在细胞中的。
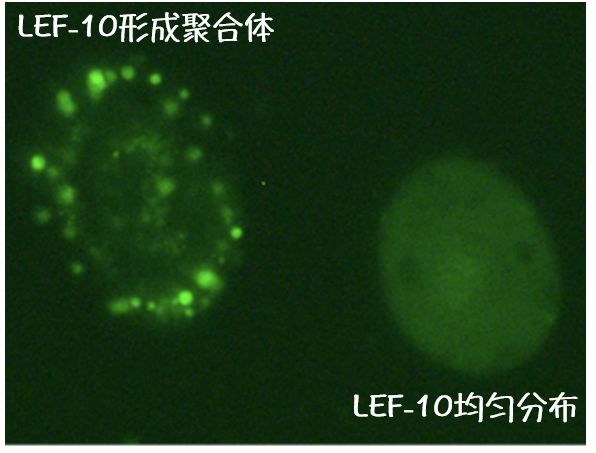
(LEF-10聚合体仅在少量细胞中出现。图片来源:参考文献[1])
这些线索的碎片拼接在一起,让黑暗中主人公的影子渐渐显露出身形。它们在许晓东脑海中拼出了一个单词—— prion(朊病毒) 。

(被朊病毒感染的组织切片观察。图片来源: Wikimedia Commons)“ 朊病毒 ”这个概念对于大部人来说,多少有些陌生。它名叫病毒却不是病毒,而是一类出了bug(错误折叠)的蛋白质。朊病毒具有感染性,有时会造成致命的疾病。众所周知的疯牛病、阿尔兹海默症,都与这类蛋白有密不可分的关系。

(阿尔兹海默症与这类蛋白有密不可分的关系。图片来源:图虫创意)
这些出错的蛋白往往具有特殊的结构,这种结构能让它们在某些条件下相互吸引,肩并肩紧紧粘在一起,形成坚实的高分子聚合体。这样的聚合体很难被蛋白酶水解,普遍 能够耐受高温、辐射和普通的蛋白变性剂 。
这也就解释了文章开头浓缩胶里那个异常信号的成因—— LEF-10和目前已知的大部分朊病毒形成的聚合体类似,具有抵抗SDS变性的特性 。100℃的高温和SDS的联合处理,都没有办法将这种蛋白聚合体拆开,这样“大块头”的蛋白聚合体自然会卡在浓缩胶中里出不来。
另外,许晓东在LEF-10上发现的现象和朊病毒其他一些特征也能够对应上,比如:朊病毒聚合体大多都不均一,分子量会呈现为倍数关系;一般朊病毒的形成需要某些特定的因素,因此仅会在少数细胞中变成聚合体。
这么一来,许晓东的研究前景变得豁然开朗。
当时,科学界仅在哺乳动物和真菌中发现过朊病毒,还 没有人报道过病毒中的朊病毒 。
他在2013年底的组会上对已有的工作做了总结,并将下一阶段的目标定为: 证实LEF-10是朊病毒,为“朊病毒广泛存在假说”提供更多实例 。
论证之路上的一波三折
在探索科学问题的过程中,从“观察现象”到“提出假设”只是迈出了关键的第一步。只有通过合适的方法证实和严谨的逻辑论证,从不同的角度拿到充足的证据,证明现象与原因间的“必然性”,才能得到科学界的广泛认可。
即便有了研究方向,论证的过程往往也没有那么容易。
研究朊病毒,许晓东将面对重重困难:他的课题组既没有这方面的研究经验,也没有合适的工具和技术体系。朊病毒研究对他们来说,几乎是完全陌生的领域。
在没有研究基础的情况下开拓新领域,对他们这样一个小课题组来说,无疑要承担巨大的风险和挑战。但是,迎接这样的挑战,在许晓东看来,正是他做科研的乐趣所在和动力之源。
之后的很长时间,许晓东开始拼命阅读朊病毒的相关文献。他梳理出朊病毒的 4个核心特征 :
1、能以非朊病毒和朊病毒两种稳定状态存在;
2、其中一种状态可以自发或受某种诱导转变成另一种状态;
3、在某种情况下,朊病毒状态可以被“治愈”;
4、两种状态都可遗传下去。
也就是说,LEF-10至少需要通过这4项考验,才有可能拿到朊病毒的“身份证”。而要对它验明正身,就必须有一套行之有效且能被同行认可的鉴定体系。
酵母系统壁垒
目前,在朊病毒领域,学术界认可的鉴定体系是由已故的著名生物学家苏珊·林德奎斯特(Susan Lindquist, 1949-2016)建立的酿酒酵母Sup35p鉴定方法 [2] 。

(苏珊·林德奎斯特.图 片来源: Wikimedia Commons)
对许晓东而言,通过这个鉴定体系证实LEF-10的朊病毒特性,是让科学界承认LEF-10是朊病毒的必由之路。
他立刻给 苏珊 院士的得意门生——酵母朊病毒鉴定的顶级专家 兰德尔·哈尔夫曼(文章开头提到的那位) 写邮件寻求这套系统, 哈尔夫曼 同意了,并告知他们“这套系统很棘手(tricky),你们做不出来”,许晓东发了地址过去,但最后不知为何始终没有收到回复。
几经辗转,直至2014年底,在妻子陈红英的帮助下,许晓东终于从英国肯特大学酵母朊病毒科学家米克·图特(Mick Tuite)那里拿到了类似的系统。相较美国科学家的系统,图特的系统能够更加严谨地对朊病毒进行鉴定。
拿到了酵母系统,欣喜之余,暗藏的挑战接踵而至。
这套系统远比许晓东想的复杂与艰难。一方面是系统自身非常复杂,需要深厚的遗传学背景才能知晓其中的原理。另一方面, 这类实验操作对很多细节的要求异常严苛 ,最好有熟练掌握这一技术的人手把手教上好几年,才能获得所有要领,否则“照着说明书也做不出来”。
长久以来,这个领域的新发现几乎都被几个酵母领域的研究团队“垄断”。所以, 哈尔夫曼 说他们“做不出来”,其实也不是没有道理。
毕竟,与哈佛大学、麻省理工学院的资深团队相比,许晓东他们无论在试验条件还是技术经验上均存在不言而喻的天壤之别。
然而这些困难丝毫没有动摇许晓东的决心。他找到了当时正在读研二的硕士生,南昊。

(南昊(图左)与许晓东(图右)。图片来源:南昊)
南昊是个非常擅于思考的学生,他平时涉猎广泛,对很多科学问题都有自己的独特见解,也懂得该如何设计试验。
一开始,南昊对这个课题没什么兴趣,但没过多久,他就被这个领域深深吸引,觉得“越做越有趣”。 南昊渐渐意识到,这项研究一旦成功,将是一次能够“更新教科书”的成果 。
南昊全身心投入到研究中,夜以继日地做实验。
事实证明,“壁垒”是真实存在的。这套酵母系统非常顽劣,南昊每一步都严格按照论文里提供的方法来做,但就是做不出结果,走了很多弯路。
他和许晓东反复讨论细节不断改进方案。后来,随着文献的不断积累和操作上的日臻成熟,桀骜难驯的酵母系统一点点低下了高傲的头颅,渐渐发挥出了功效。鉴定路上的四道大门被一道道解锁。
与时间赛跑
酿酒酵母中,存在一种天然的朊病毒Sup35p。正常情况下,这个蛋白的功能是让翻译过程在该停的地方停下来。但受到某些刺激时,Sup35p蛋白会表现出朊病毒特性,在细胞中变为聚集体,就会失去对翻译过程的管控,出现许多过度翻译延长的蛋白质,最终影响酵母的表型。
这样的变化虽然会使一些正常的蛋白失去功能,但同时也会让一些提前终止突变(翻译一半就停了)的蛋白恢复功能。例如,在酿酒酵母LJ14菌株中,它的腺苷酸合成通路中的ade基因中间就含有一个由突变产生的提前终止密码子。
在Sup35p正常发挥功能时, ade 基因翻译到一半就终止了,因此LJ14菌株没办法自己合成腺苷酸,只能在额外提供了腺苷酸的培养基上生存。同时, ade 基因的失效,使得腺苷酸合成的前体物在细胞中积累。
非常有趣的是,这种前体物是一种红色的色素分子,能让酵母呈现为红色。但当Sup35p转变为朊病毒时, ade 基因中的提前终止密码就不起作用了,核糖体能够通读过去,形成有功能的Ade蛋白,酵母就会变为白色。
这样一来,只要用其他的DNA序列替代Sup35p,不就可以通过颜色表型初步检测那段序列是否可以编码朊病毒了?
于是,许晓东和南昊将LEF-10蛋白上的具有朊病毒特征的部分氨基酸替换在了酵母的Sup35p蛋白上。成功的观察到了和野生Sup35p相似的效果。
1.培养基上既有红色菌落又有少量白色菌落——说明LEF-10能以非朊病毒和朊病毒两种稳定状态存在;
2.挑选红色的菌落中酵母传代,能观察到自发形成的新的白色菌落——说明其中一种状态可以自发或受某种诱导转变成另一种状态;
3.抑制或敲除了能促进朊病毒聚集的分子伴侣HSP104之后,LEF-10也会从朊病毒态的白色菌落变为非朊病毒态的红色菌落——证明在某种情况下,朊病毒状态可以被“治愈”;
4.白色菌落传代能产生白色菌落,红色菌落传代也能产生红色菌落——证明两种状态都可遗传下去。
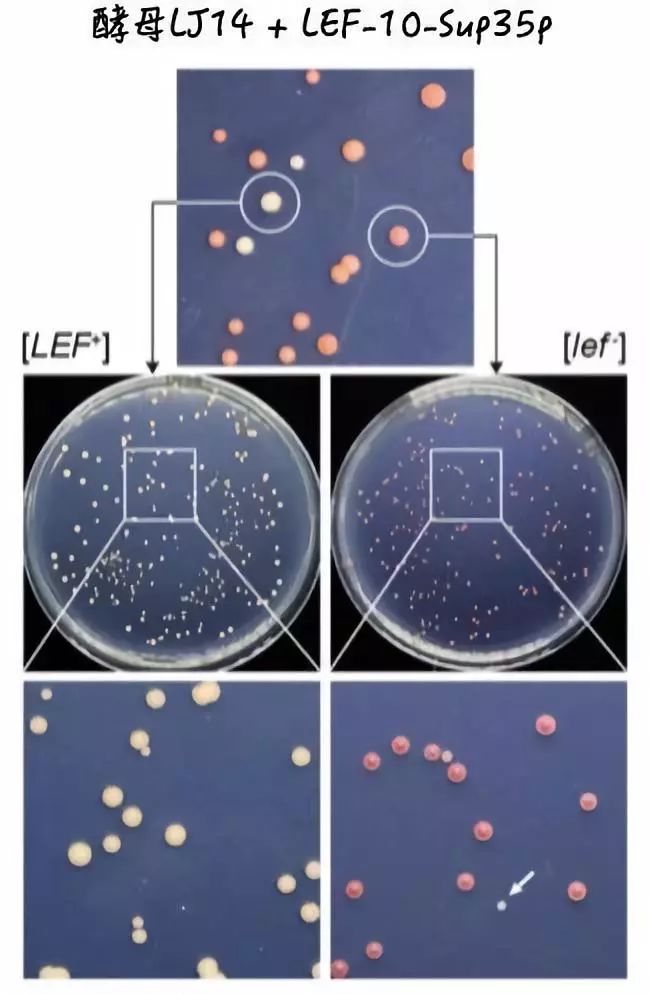
(利用酵母系统验证病毒中的朊病毒。图片来源:参考文献[1])
由此,LEF-10的朊病毒特性几乎可以说是板上钉钉了。
除此之外,他们陆续从其他角度(如该杆状病毒侵染的昆虫细胞、SDD-AGE等)共同证实了LEF-10的朊病毒特性;并找到了对LEF-10形成聚集体关键的氨基酸残基位点 [1,3] 。

(LEF-10的蛋白结构预测。图片来源:参考文献[1])
就在他们收集证据的过程中,2017年1月,《科学》杂志上报道了第一个细菌中的朊病毒 [4] ,这让许晓东团队受到鼓舞也倍感压力,他们必须和时间赛跑,不然很可能被其他人超越。
终于到了投稿的阶段,可能由于他们研究的对象(昆虫病毒)比较“冷门”,先后被几家顶级期刊拒稿后,最终被《自然-通讯》正式接收。 在朊病毒鉴定领域中,第一次出现中国团队的身影 。

(团队主要成员许晓东。图片来源:南昊)
这项研究成果得到了酵母朊病毒领域元老 米克·图特 的认可(就是前面说到的提供酵母系统的教授),也让许晓东当年的导师琼斯倍感意外,他没想到自己的学生可以把杆状病毒中的朊病毒做到这个程度。
启示
你可能会问,病毒中发现了朊病毒,意味着什么呢?
病毒作为最小的生命形式,一共也没有多少基因,这个蛋白对杆状病毒来说有意义吗?
这里就要回到第二条线索—— LEF-10的聚合体上带有DNA 。这意味着,它很可能是一种转录因子,在昆虫体内会控制一些基因的表达。
病毒感染宿主后会开始大量复制,当他们数量太多的时候,就会过度消耗宿主的资源,并威胁到宿主的生命。
如果宿主死亡,病毒也就无法存活。
据推测,LEF-10蛋白单体行使的本职工作是促进病毒复制,当感受到宿主资源不足时,这些单体就开始聚集。聚集后的LEF-10不能行使原有功能,从而扼制晚期基因的表达,限制病毒的复制,让宿主有喘息之机,最终实现病毒和宿主间的平衡关系。
这种调控方式可以被看成是一种“刹车机制”(可以理解为“节育”)。这种机制有利于病毒在宿主体内更长久的持续复制,能够让宿主存活更久,将其带到更远的地方“繁衍生息”。

(图片来源:参考文献[1](Nekout汉化))
另一方面,在病毒中发现朊病毒,也为解释许多朊病毒相关的疾病提供了一种新的可能。
比如,长久以来困扰着全世界科学家的 阿尔兹海默症 。
在这项研究之前,科学界就早已发现了一种朊病毒能使另外一种不同的蛋白转化为新的朊病毒 [5-7] 。
例如,在人的神经细胞中淀粉样蛋白Amyloid beta(Aβ)能引发Tau蛋白聚集成具有细胞毒性的富β-片层状聚合体 [8] 。不仅人自身的内源蛋白可以诱发这一过程。一些来自于病原微生物的淀粉样蛋白也有类似的能力 [9] 。
近年来,已经有很多研究发现病毒感染与阿茨海默症发病之间存在关联 [10-12] ,但还说不清具体的关系是什么。而这项研究就给了人们一个新的提示: 如果某些人源病毒,如疱疹病毒,也编码类似的蛋白,一旦它在某些情况下入侵人脑,并产生朊病毒,就有可能诱发阿尔兹海默症。
当然,这样的假设还有待进一步验证,但它为研究病毒感染与阿尔兹海默症发病之间的必然性,提供了一个新的方向。
从困境到曙光
心之所向,虽远必达。
时至此刻,17年前那次“异常现象”埋下的小小种子,终于在几位执着的科研人的悉心呵护下萌芽长大,为朊病毒在不同生命形式的发现史盖上“收官之印”。
而这些年,他们付出了太多常人无法想象的艰辛。
由于研究方向过于生僻,许晓东常年申请不到课题,评不上职称,至今仍是一位七级副教授。因为缺少经费,他也不具备招生资格,大部分实验都由南昊一人完成,偶尔还需要亲自上阵。截至文章接收时,许晓东的账面经费已不足千元。
许晓东的妻子陈红英教授一直很支持他的工作,不惜牺牲一些自己很喜欢的课题,给予许晓东各方面的支持与鼓励。
南昊为了这个课题,毕业后放弃了考博和工作的机会,主动留在实验室继续做实验,全年没有休过假,甚至过年都不回家。没有补助,就在实验间隙出去打工赚钱。
多年的坚守与付出终于有了回报。许晓东在日志中认认真真感谢了每一位给予过他帮助的人,并感慨的写下这样一句话:“ 我们终究是幸运的,终于活着看见了今天的朝霞 。”
病毒中发现阮病毒的故事,讲到这里也接近尾声。它源于不经意的好奇,陷于刨根问底的探寻,又归于波澜不惊的平静。
不过,这个小团队没有就此停下前行的脚步,他们准备继续深入研究LEF-10的功能和结构,并着手开发一套鉴定朊病毒的原核系统,为更多想做朊病毒研究的学者提供方便可行的工具。
与此同时,已经有其他做病毒的课题组也在浓缩胶中发现了相似的“异常信号”,联系他们帮忙鉴定;还有的课题组找到他们合作解析LEF-10的蛋白结构。而这样的合作,放在以前是不可能发生的事。
未来,还会有更多病毒中的朊病毒被学者们发现和研究。那时候,一定会有一篇来自中国的研究出现在他们的引文中: A viral expression factor behaves as a prion .

作者名片


排版:小爽
参考文献:
1.Hao Nan, Hongying Chen, Mick F. Tuite & Xiaodong Xu. A viral expression factor behaves as a prion. Nature Communications, 10: 359 (2019)
2. Alberti et al. A Systematic Survey Identifies Prions and Illuminates Sequence Features of Prionogenic Proteins. Cell, 2009, 137:146-158
3.Xu X, Chen Y, Zhao Y, Liu X, Dong B, Jones IM, Chen H. 2013 Baculovirus superinfection: a probable restriction factor on the surface display of proteins for library screening. PLoS One. 8(1):e54631. doi: 10.1371/journal.pone.0054631
4. Yuan, A. H. & Hochschild, A. A bacterial global regulator forms a prion. Science 355, 198–201 (2017).
5.Derkatch et al. Prions affect the appearance of other prions: the story of [PIN(+)]. Cell, 2001, 106: 171-182.
6.Guo et al. Distinct alpha-synuclein strains differentially promote tau inclusions in neurons. Cell, 2013, 154: 103-117.
7.Keefer et al. Heterologous prion-forming proteins interact to cross-seed aggregation in Saccharomyces cerevisiae. Sci Rep, 2017, 7:5853.
8.Gotz et al. Formation of neurofibrillary tangles in P301l tau transgenic mice induced by Abeta 42 fibrils. Science, 2001, 293: 1491-1495.
9.Chen et al. Exposure to the Functional Bacterial Amyloid Protein Curli Enhances Alpha-Synuclein Aggregation in Aged Fischer 344 Rats and Caenorhabditis elegans. Sci Rep. 2016, 6:34477.
10.Itzhaki et al. Herpes simplex virus type 1 in brain and risk of Alzheimer's disease. Lancet, 1997, 349: 241-244.
11.Readhead et al. Multiscale Analysis of Independent Alzheimer's Cohorts Finds Disruption of Molecular, Genetic, and Clinical Networks by Human Herpesvirus. Neuron. 2018, in press.
12.Eimer et al. Alzheimer's Disease-Associated beta-Amyloid Is Rapidly Seeded by Herpesviridae to Protect against Brain Infection. Neuron, 2018, 99: 56-63 e53.




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国
