
接收人:小特工 老探员
热报:2个:第一批鼓励仿制药品目录、第一批国家重点监控合理用药目录

周六好。又到了α科技情报站的时间。
今天阿尔法带小特工和老探员关注的科技情报——都关于药品,而且都是目录。
一个是第一批鼓励仿制药品目录;另一个是第一批国家重点监控合理用药目录。
今天的情报,写了好长时间,都感觉不怎么好懂,在阅读上具有一些难度。但是它们对于医学界,尤其是药学界来说,都很有价值。
纠结来纠结去,只好选择优先把新闻事实讲清楚了。如果小特工和老探员有什么问题,在文章下留言再问阿尔法吧。
第1件事,先来。
2019年6月20日起,第一批鼓励仿制药品目录建议清单在国家卫生健康委员会官网进行公示。首批清单不乏临床常用药品,包括儿童白血病常用药巯嘌呤、抗癌药甲氨蝶呤片、艾滋病用药利匹韦林、哮喘病用药富马酸福莫特罗吸入剂等34种药品。
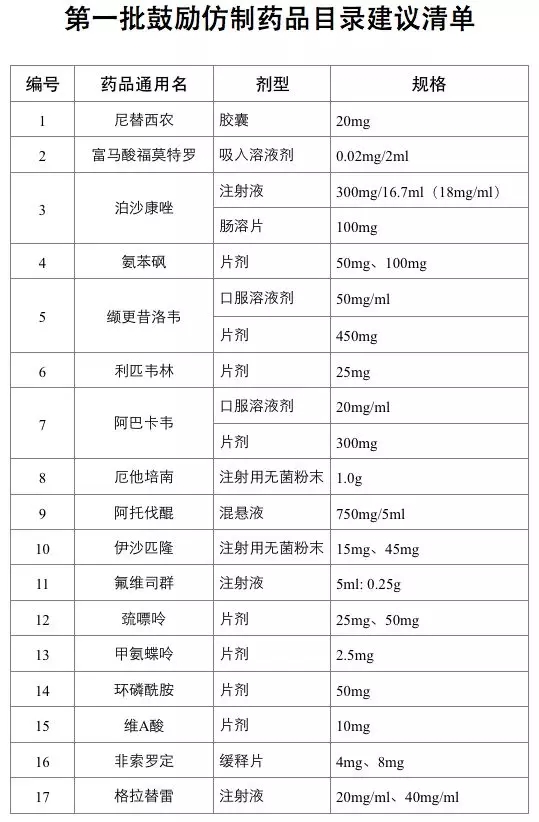
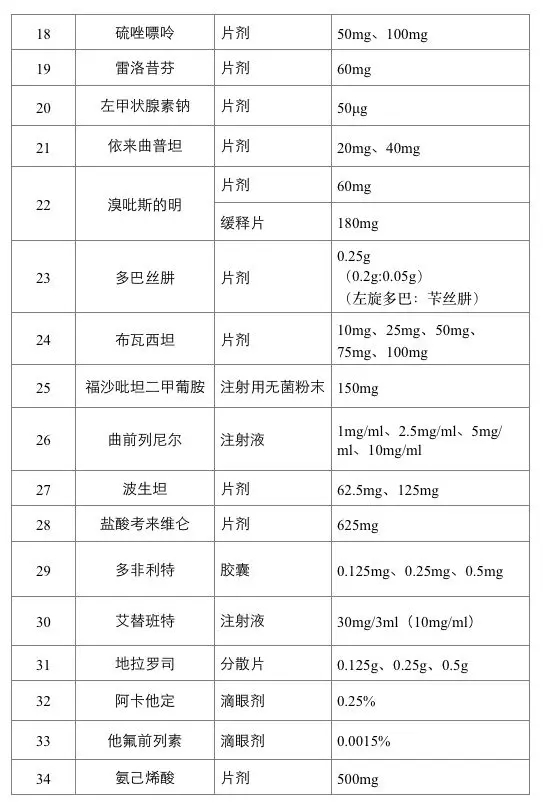
明年起,目录将在每年底前更新。进入目录的药品不仅意味着政府部门鼓励企业研发、生产,药品注册上市时还可享受优先审批。
可能小特工老探员要问了:为什么要制定鼓励仿制的药品目录?意义何在?
要知道在2012年-2016年,全球共有631个原研药专利到期,由于信息不对称、技术难度大以及一些罕见病药品市场规模较小等原因,国内仿制跟进的速度很慢,许多专利到期药,没有企业提出仿制注册申请。
通过制定鼓励仿制的药品目录,及时发布供求关系,解决供需双方的信息不对称,并对列入目录内的药品注册申请优先审评审批,以鼓励引导制药企业和研发机构有序研发、注册和生产,让更多制药企业通过公开竞争方式获得仿制研发权益,促进更多临床必需、疗效确切、供应短缺的仿制药尽快上市,一方面可以解决部分原研药价格过高问题,一方面可以解决部分药品在我国短缺的问题,大力提高药品的可及性和供应保障能力。
这鼓励仿制药通常有两种情况:
一种是国内专利到期和专利即将到期,但尚无提出注册申请的情况。这往往与这类产品的制剂技术难度、市场规模、专利实际到期日、国内审评审批速度这五个因素有关,特别是我国国内专利到期但国外专利没到期,意味着原料药供应可能只能自研或找国内的原料药供应商。
另一种是临床供应短缺(竞争不充分)。这种仿制药申报不充分主要有两个因素:一是经济性,产品市场规模潜力不大;二是因为原料药短缺,或者原料药的价格与制剂的价格倒挂。
目前在国际上已普遍采取鼓励创新和鼓励仿制并重的政策取向,并在促进仿制药研发创新、供应保障、临床使用等方面进行积极探索。
有个小秘密要透露一下:相对于口服固体制剂,注射剂可能更容易获批。这意味着2019年这一批鼓励仿制药目录的34个产品中,泊沙康唑注射液、厄他培南注射用无菌粉末、伊沙匹隆注射用无菌粉末、氟维司群注射液、格拉替雷注射液、福沙吡坦二甲葡胺(福沙匹坦双葡甲胺)注射用无菌粉末、曲前列尼尔注射液、艾替班特注射液的首仿厂家非常有可能在2020年前获批。
第2件事。
2019年7月1日,国家卫健委下发的《关于印发第一批国家重点监控合理用药药品目录(化药及生物制品)的通知》(下文简称《通知》)称,国家卫健委同中医药局在各地报送的省级推荐目录基础上,形成了《第一批国家重点监控合理用药药品目录(化药及生物制品)》(以下简称《目录》)。供各地在加强合理用药管理、开展公立医院绩效考核等工作中使用。
因为内容繁多,把重点做一个梳理吧:
制定省级和各医疗机构目录
《通知》要求各省级卫生健康行政部门要会同中医药主管部门在《目录》基础上,形成省级重点监控合理用药药品目录并公布。公布后及时报国家卫生健康委和国家中医药局备案。
各级各类医疗机构在省级目录基础上,形成本机构重点监控合理用药药品目录。省级和各医疗机构的目录应当按照要求以政务公开、院务公开、官方网站公示等形式向社会公布。
重点监控目录药品,全部处方审核
各医疗机构要建立重点监控合理用药药品管理制度,加强目录内药品临床应用的全程管理。进一步规范医师处方行为,对纳入目录中的药品制订用药指南或技术规范,明确规定临床应用的条件和原则。已有相关用药指南或指导原则的,要严格按照指南或原则执行。
对纳入目录中的全部药品开展处方审核和处方点评,加强处方点评结果的公示、反馈及利用。对用药不合理问题突出的品种,采取排名通报、限期整改、清除出本机构药品供应目录等措施,保证合理用药。
医师开具中药处方受限,要有四类资质
对未纳入目录的化药、生物制品,医师要严格落实《处方管理办法》等有关规定,按照药品说明书规定的适应证、疾病诊疗规范指南和相应处方权限,合理选择药品品种、给药途径和给药剂量并开具处方。
值得注意的是,此次《通知》对医师开具中药处方提出了严格要求,必须有中医类别执业医师资格或者中医类相关培训经验,这对全国临床专业的医师来说影响巨大,《通知》中明确表示能开具中药处方的医师资质如下:
1.中药、中医类别医师
对于中药、中医类别医师应当按照《中成药临床应用指导原则》《医院中药饮片管理规范》等,遵照中医临床基本的辨证施治原则开具中药处方。
2.一年中医药专业培训合格医师
其他类别的医师,经过不少于1年系统学习中医药专业知识并考核合格后,遵照中医临床基本的辨证施治原则,可以开具中成药处方。
3.参加省级以上西医学中医培训班,取得相应证书
取得省级以上教育行政部门认可的中医、中西医结合、民族医医学专业学历或学位的,或者参加省级中医药主管部门认可的2年以上西医学习中医培训班(总学时数不少于850学时)并取得相应证书的。
4.拥有《传统医学师承出师证书》
或者按照《传统医学师承和确有专长人员医师资格考核考试办法》有关规定跟师学习中医满3年并取得《传统医学师承出师证书》的,既可以开具中成药处方,也可以开具中药饮片处方。
加强药品临床使用监测和绩效考核
各级卫生健康行政部门、中医药主管部门和各医疗机构要建立完善药品临床使用监测和超常预警制度。
重点将纳入目录的药品临床使用情况作为医疗机构及其主要负责人的考核内容,与医疗机构校验、评审评价、绩效考核相结合,考核结果及时公示。
对尚未纳入目录管理的药品,做好常规临床使用监测工作,发现使用量异常增长、无指征、超剂量使用等问题,要加强预警并查找原因。对存在违法违规行为的人员要严肃处理。
第一批国家重点监控合理用药药品目录
序号
药品通用名
1
神经节苷脂
2
脑苷肌肽
3
奥拉西坦
4
磷酸肌酸钠
5
小牛血清去蛋白
6
前列地尔
7
曲克芦丁脑蛋白水解物
8
复合辅酶
9
丹参川芎嗪
10
转化糖电解质
11
鼠神经生长因子
12
胸腺五肽
13
核糖核酸Ⅱ
14
依达拉奉
15
骨肽
16
脑蛋白水解物
17
核糖核酸
18
长春西汀
19
小牛血去蛋白提取物
20
马来酸桂哌齐特
Ok,今天的科技情报就解读到这里。

用实力让情怀落地。如果有一天,你发现我在平庸面前低了头,请向我开炮。

阿尔法参考情报:
1.国家卫健委官网
2.新京报
3.医学界
4.医药经济报



 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国
