归中反应就是指同种元素组成的不同物质(可以是单质和化合物,也可以是化合物和化合物)发生氧化还原反应,元素的两种化合价向中间靠拢。归中反应与歧化反应相对。1
基本介绍“归中”即高值与低值同时向中间值靠拢。“归中反应”就是物质某种性质的高值与低值反应生成中间值。归中反应是中学化学中一类较为常见的反应,若能具备其思想,对于物质化学性质的掌握和化学方程式的书写将大有裨益。
规律邻位转化规律发生氧化还原反应时,元素的化合价升高或者降低到相邻的价态。
如:S有-2,0,+4,+6的价态,如果是0价的S参加反应,则升高到临近的+4,或降低到临近的-2。
跳位转化规律一般都满足邻位规律,但是如果遇到强氧化剂或强还原剂,则会被氧化为高价态或还原为低价态。
如:-2价的S如果遇到一般的氧化剂,则被氧化到0价【2H2S+SO2====3S↓+2H2O】(反应方式不是仅有的方法,图示为配平方法),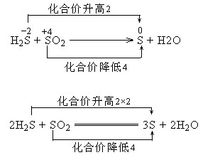 但如果遇到强氧化剂,则可能被氧化到+6价。
但如果遇到强氧化剂,则可能被氧化到+6价。
含不同价态同种元素的物质在发生氧化还原反应时,该元素价态的变化一定遵循【高价+低价→中间价】的规律,不会出现交错现象。
如在反应【2Na2S+SO2====2Na2O+3S】中,Na2S中的S是-2价,它跟SO2反应后生成S为0价的S。
价态归中规律不同价态的同种元素间发生氧化还原反应,其结果是两种价态只能相互靠近或最多达到相同的价态,而绝不会出现高价态变低、低价态变高的交叉现象。
其中价态归中是指高价态的化合价降低,低价态的化合价升高,但不可能低价态的元素最后升的比原来高价态化合价还高,即同种元素的不同价态反应遵循“可靠拢不相交”。
中间价态规律含有同一元素的不同价态的两种物质,只有当这种元素有中间价态时,才有可能发生归中反应。而且高低价态变化的结果是生成该元素的中间价态。
利用中间价态理论可以解释为什么二氧化硫可用浓硫酸干燥(因为不存在+5价的S)。1
相关示例氧化还原反应中的归中反应
含有同一元素的不同价态的两种物质发生反应,生成只含有该元素中间价态的物质的反应叫做归中反应。
碳和二氧化碳反应【C+CO2==高温==2CO】
硫化氢和二氧化硫****反应【SO2+2H2S====3S↓+2H2O】
硫化氢和亚硫酸反应【H2SO3+2H2S====3S↓+3H2O】
铁和铁离子反应【Fe+2Fe3+====3Fe2+】
次氯酸钙****和浓盐酸反应【Ca(ClO)2+4HCl(浓)====2Cl2↑+CaCl2+2H2O】
溴****的归中【5NaBr+NaBrO3+3H2SO4====3Br2+3Na2SO4+3H2O】
铜和氧化铜反应【CuO+Cu=Cu2O】
硫化氢和浓硫酸反应(设n(H2S):n(H2SO4)=n)
n=1【H2S+H2SO4====S↓+SO2↑+2H2O】(等体积)
n>1【3H2S+H2SO4====4S↓+4H2O】(H2S过量)
n




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国