离子半径是描述离子大小的参数。取决于离子所带电荷、电子分布和晶体结构型式。设r阳为阳离子半径,r阴为阴离子半径。r阳+r阴=键长。r阳/r阴与晶体类型有关。可从键长计算离子半径。一般采用Goldschmidt半径和Pauling半径,皆是NaCl型结构配位数为6的数据。Shannon考虑了配位数和电子自旋状态的影响,得到两套最新数据,其中一套数据,参考电子云密度图,阳离子半径比传统数据大14pm,阴离子小14pm,更接近晶体实际。
简介概述
离子半径反映离子大小的一个物理量。离子可近似视为球体,离子半径的导出以正、负离子半径之和等于离子键键长这一原理为基础,从大量X射线晶体结构分析实测键长值中推引出离子半径。离子半径的大小主要取决于离子所带电荷和离子本身的电子分布,但还要受离子化合物结构型式(如配位数等)的影响,离子半径一般以配位数为6的氯化钠型晶体为基准,配位数为8时,半径值约增加3% ;配位数为4时,半径值下降约5%。负离子半径一般较大,约为1.3~2.5埃;正离子半径较小,约为0.1~1.7埃。根据正、负离子半径值可导出正、负离子的半径和及半径比,这是阐明离子化合物性能和结构型式的两项重要因素。
例如:Na+在配位数为4、6、8、9、12时,离子半径分别是99、102、118、124、139 pm;O2-离子的半径在配位数为2、6、8时,离子半径分别为121、140、142 pm等。
离子半径大小的判断方法
(1)同一元素的微粒,电子数越多,半径越大。如钠原子>钠离子,氯原子锂离子;
(3)同类离子与原子半径比较相同。如钠离子>镁离子>铝离子,氟离子钠离子>镁离子>铝离子 硫离子>氯离子>钾离子>钙离子;
(5)同一元素高价阳离子半径小于低价阳离子半径,又小于金属的原子半径。如铜离子四价硫>六价硫。1
离子半径的测定
通过 一射线晶体分析的方法 ,可以测定阴阳离子之间的距离, 由离子间距离,相同类型电子结构的离子, 由几种晶体,不同的正负离子的接触情况,就可算出离子半径值。鲍林曾从另一角度研究过离子半径问题。离子半径由于配位数的不一样而有所不同,当配位数为a 时,以配位数为6 作标准可计算得: ra ,ra=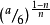 ,n 为波恩指数( 配位数为12、8、6、4 时,相应除系数1.12、1.03、1.0、0.94 ), 但从实际数据回算,似乎并不完全符合公式。由离子半径的定义及其值的确定可见, 实际存在的各元素离子形成的晶体与NaCI 型离子晶体有差别; X 一射线测定需要有结晶好的晶体,但往往有不少元素的离子晶体很难制备,或结晶不好,所以前人所提供的离子半径值相互之间存在差异, 以及有些价态没有离子半径值就不足为奇了。2
,n 为波恩指数( 配位数为12、8、6、4 时,相应除系数1.12、1.03、1.0、0.94 ), 但从实际数据回算,似乎并不完全符合公式。由离子半径的定义及其值的确定可见, 实际存在的各元素离子形成的晶体与NaCI 型离子晶体有差别; X 一射线测定需要有结晶好的晶体,但往往有不少元素的离子晶体很难制备,或结晶不好,所以前人所提供的离子半径值相互之间存在差异, 以及有些价态没有离子半径值就不足为奇了。2
常见的离子半径
原子序数 | 元素名称 | 元素符号 | 离子半径pm |
3 | 锂 | Li | +1: 76 |
4 | 铍 | Be | +2: 45 |
5 | 硼 | B | +3:27 |
6 | 碳 | C | +4:16 |
7 | 氮 | N | −3:146 +3:16 +5:13 |
8 | 氧 | O | −2:140 |
9 | 氟 | F | −1:133 +7:8 |
11 | 钠 | Na | +1:102 |
12 | 镁 | Mg | +2:72 |
13 | 铝 | Al | +3:53.5 |
14 | 硅 | Si | +4:40 |
15 | 磷 | P | +3:44 +5:38 |
16 | 硫 | S | −2:184 +4:37 +6:29 |
17 | 氯 | Cl | −1:181 +5:12 +7:27 |
19 | 钾 | K | +1:138 |
20 | 钙 | Ca | +2:100 |
本词条内容贡献者为:
张磊 - 副教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国