水合氢离子指的是氢原子在失去电子后,剩余由1个质子构成的核,即氢离子,氢离子是“裸露”的质子,半径很小,易被水分子吸引生成水合氢离子,通常用H3O+表示,所以水的电离可以用以下方程式表示2H2O=H3O++OH-。水合氢离子是最简单的钅羊(Oxonium)。
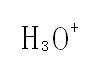 水合氢离子,指的是氢原子在失去电子后,剩余由1个质子构成的核,即氢离子,氢离子是“裸露”的质子,半径很小,易被水分子吸引生成水合氢离子,通常用H3O+表示,所以水的电离可以用以下方程式表示:2H2O=H3O++OH-。1
水合氢离子,指的是氢原子在失去电子后,剩余由1个质子构成的核,即氢离子,氢离子是“裸露”的质子,半径很小,易被水分子吸引生成水合氢离子,通常用H3O+表示,所以水的电离可以用以下方程式表示:2H2O=H3O++OH-。1
水(H2O)的中心元素是O,O的最外层有6个电子,其中有一对在2s轨道,四个电子在2p轨道(其中一对电子在2px轨道,剩下两个分别在2py和2pz),这里面2py、2pz的那两个电子分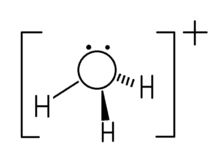 别与氢成键,剩下一对电子对空余。
别与氢成键,剩下一对电子对空余。
水合氢离子是H3O+中,就是有一个H+与空余的2px轨道中的电子对成键所构成的(这里面氢核周围没有电子,氧把两个电子都给H,形成配位键),但不改变原来的sp3杂化。
实际上,水合氢离子在稀酸中进一步水合,以H9O4+或H3O+·3H2O1形式存在,即三个个H2O的氧原子与H3O+的质子形成氢键。
固态水合氢离子盐很多强酸都可能形成相对稳定的水合氢离子盐晶体。这些盐有时被称为酸的一水合物。通常,任何具有109或更高的电离常数的酸都可以形成水合氢离子盐。而电离常数小于109的酸一般不能形成稳定的H3O+盐。
例如,盐酸的电离常数为107,在室温下与水的混合物是液态的。而高氯酸的电离常数为1010,如果液体无水高氯酸和水以1:1的摩尔比结合,则反应形成固体一水合高氯酸,即高氯酸的水合氢离子盐:2
H2O+HClO4=H3O+·CLO4-
结构水合质子的结构问题一直是分析界的一大难题,质子在水中的状态,并不是一般认为是H3O+的结构或者H5O2+的结构,X射线衍射结果表明,存在的氢键并不是传统意义上的O——H···O,而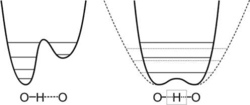 是O···H···O,后者拥有更短的O···O间距和更低的势垒,使得质子可以轻易的在两侧势井中移动,中间势垒低,加上质子具有类似于电子透射势垒的运动,使得质子被束缚在两个氧之间,但是却是非定域的。
是O···H···O,后者拥有更短的O···O间距和更低的势垒,使得质子可以轻易的在两侧势井中移动,中间势垒低,加上质子具有类似于电子透射势垒的运动,使得质子被束缚在两个氧之间,但是却是非定域的。
由于它是堆成结构,中间势垒低,在低振动态的情况下,分子就可以越过势垒,就会有很高的透射率。因此常温下存在这种结构是可能的。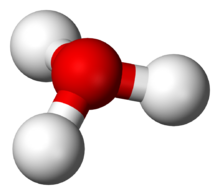
由于O+和N原子具有相同的电子数,因此H3O+与NH3的电子数相等,从H3O+的球棍模型可以看出,其具有氧原子位于顶点的三角锥形分子构型,H-O-H的夹角大约为113o,同时质心非常靠近氧原子3。因为金字塔的底部是由三个相同的氢原子组成的,H3O+分子的对称顶部结构属于C3v点群。因为这个对称和它有偶极矩的事实,旋转选择规则是ΔJ=±1 和ΔK=0。过渡偶极子在c轴上,由于负电荷在氧原子附近,因此偶极矩指向顶点,垂直于基面。
本词条内容贡献者为:
张磊 - 副教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国