定义
由于理想气体作了两个近似:忽略气体分子本身的体积和分子间的相互作用力,所以实际气体都会偏离理想气体。偏离的程度取决于气体本身的性质以及温度、压强等因素。一般而言,沸点低的气体在较高温度和较低压强时偏差较小,反之偏差较大。
压缩因子Z被引用来修正理想气体状态方程: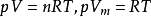 。
。
压缩因子的定义式为: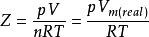 ,压缩因子的量纲为一。
,压缩因子的量纲为一。
很显然,Z的大小反映出真实气体对理想气体的偏差程度,即Z等Vm(真实)除以Vm(理想)。由于Z反映出真实气体压缩的难易程度,所以将它称为压缩因子。
可以看出,Z是同样条件下真实气体摩尔体积与理想气体摩尔体积的比值,它的大小反映出真实气体偏离理想气体的程度。理想气体的Z值在任何条件下恒为1。Z小于1说明真实气体的摩尔体积比同样条件下理想气体的为小,真实气体比理想气体更易压缩。Z大于1则相反。由于它反映出真实气体的压缩难易程度,所以称为压缩因子。压缩因子的量纲为一。
性质对于理想气体,在任何温度压力下,Z=1。
当ZV理想
两种相反的因素相互制约,Z的大小关键看哪一个因素占主导。2
用压缩因子表示的维里方程如下:
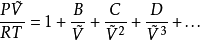
对p取导数可以看到,真实气体的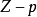 图在
图在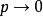 时的斜率并不为1,而是趋于一个维里系数值。但对于理想气体
时的斜率并不为1,而是趋于一个维里系数值。但对于理想气体 (因为所有压力下Z均=1)。维里系数是温度的函数;在压力低或摩尔体积大的情况下,使
(因为所有压力下Z均=1)。维里系数是温度的函数;在压力低或摩尔体积大的情况下,使 在
在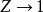 时为0的温度,称为波义耳温度。
时为0的温度,称为波义耳温度。
此外可以类似地使用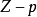 等温线代替
等温线代替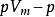 等温线,反映出真实气体对理想情况的偏差随压力的变化。所有气体在
等温线,反映出真实气体对理想情况的偏差随压力的变化。所有气体在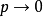 时均趋近理想气体,所以任何
时均趋近理想气体,所以任何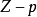 等温线在
等温线在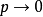 时均趋于Z=1。
时均趋于Z=1。
将压缩因子的概念应用于临界点,可以类似地得到“临界压缩因子”:
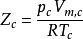
应用虽然压缩因子Z表示得是真实气体行为偏离理想状态的程度,但由于理想状态是不存在的,便无实际具体的实验数据,因而难以从压缩因子Z的物理意义上直接求出其数值。3
临界压缩因子后实验发现,各个气体在临界状态时偏离理想气体的程度大致相同。当实际气体处于临界点(临界气压Pc,临界温度Tc,临界摩尔体积Vm,c)时,定义此时的压缩因子称为临界压缩因子ZC,将方程改写为 ,测得多数气体的临界压缩因子比较接近,0.25-0.31之间。临界态是真实的,所以临界参数均可测,可求的Zc也相应列表可查。
,测得多数气体的临界压缩因子比较接近,0.25-0.31之间。临界态是真实的,所以临界参数均可测,可求的Zc也相应列表可查。
对比参数为求出其数值Z,找出Z的普遍性规律,科学家思考:为避免气体分子性质的不同而导致压缩因子Z的不同,能否导出一个不具有气体特性常数的方程呢?
随后即引入对比气压Pr,对比温度Tr,对比摩尔体积Vm,r,统称为对比参数。其定义式为: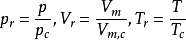 ,这三个对比参数描述了气体所处状态与临界状态的偏离程度,而与气体的本质无关。将
,这三个对比参数描述了气体所处状态与临界状态的偏离程度,而与气体的本质无关。将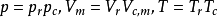 带入方程改写为
带入方程改写为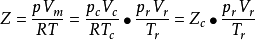 。
。
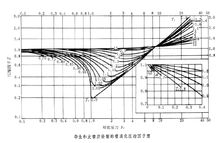
上面的方程式中右方第一项的临界压缩因子Zc数值波动不大,可看作一个常数;而右方第二项三个参数可以根据对比态原理(不同物质如果具有相同的对比压力pr和对比温度Tr,那么对比体积也相同)表示成两个参数的函数式,下面根据这两个参数得出的最为常见压缩因子图。
图形普遍化压缩因子图
荷根(Hougen)和华特生(Watson)测定了许多气体有机物质和无机物质压缩因子随对比温度Tr和对比压力Pr变化的关系,绘制成曲线,所得关系图称为"普遍化压缩因子图"。见右图。当实际气体的临界压力pc和临界温度Tc的数据为已知,可将某态下的压力p和温度T换算成相应的对比压力pr和对比温度Tr,从图中找出该对比态下的压缩因子Z。再由下式计算气体的摩尔体积Vm。




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国