在特定条件下(如温度、压力、溶剂性质、离子强度等),可逆化学反应达到平衡状态时生成物与反应物的浓度(方程式系数幂次方)乘积比或反应产物与反应底物的浓度(方程式系数幂次方)乘积比。用符号“K”表示。从热力学理论上来说,所有的反应都存在逆反应,也就是说所有的反应都存在着热力学平衡,都有平衡常数。平衡常数越大,反应越彻底。
定义概念对某一可逆反应,在一定温度下,无论反应物的起始浓度如何,反应达到平衡状态后,反应物与生成物浓度系数次方的比是一个常数,称为化学平衡常数,用K表示。1
平衡常数的表示对于下列反应: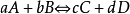 ,则有:
,则有: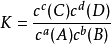 ,其中c为各组分的平衡浓度。
,其中c为各组分的平衡浓度。
使用平衡常数的注意事项(1)K只与温度有关,所以使用时应注明温度;
(2)K值表达式中,固体、液态水不写;
(3)平衡常数的表达式与方程式的书写方式有关;
(4)平衡常数表示反应进行的程度,不表示反应的快慢,即速率大,K值不一定大;
(5)利用K值可判断某状态是否处于平衡状态:未平衡时,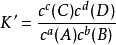 。若K'=K,反应处于平衡,v正=v逆;若K'v逆;若K'>K,反应向逆方向进行,v正105反应较完全,K
。若K'=K,反应处于平衡,v正=v逆;若K'v逆;若K'>K,反应向逆方向进行,v正105反应较完全,K




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国