同一原子内由 1 个 n s轨道和3 个np轨道参与的杂化称为sp3杂化,所形成的 4 个杂 化轨道称sp3杂化轨道。各 含 有 1 / 4的 s 成 分 和 3 / 4 的 p 成分 ,杂化轨道间的夹角为 109度28分,空间构型为正四面体。Sp3轨道杂化是基于轨道杂化理论的一个重要分支,是一种比较常见的轨道杂化方式。
杂化过程sp3杂化一般发生在分子形成过程中。杂化发生后,原子最外层s轨道中的一个电子被激发至p轨道,使将要发生杂化的原子进入激发态;之后,该层的s轨道与三个p轨道发生杂化。此过程中,能量相近的s轨道和p轨道发生叠加,不同类型的原子轨道重新分配能量并调整方向,形成4个等价的sp3轨道。1
举例例如,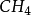 的形成,基 态 C 原子只有两个未成 对电子 ,在形成
的形成,基 态 C 原子只有两个未成 对电子 ,在形成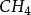 时 ,在 H 的影响下,C 的 1 个 2S轨 道 和 3 个 2 p 轨道进行sp3杂化,形 成 4 个 sp3杂化轨道,每 个 Sp3杂化轨道中各有一个未成对电子。C 用 4 个 Sp3杂化轨道分 别与4 个 H 的 1 s 轨 道 重 叠 形 成 4 个σ 键。由 于 C 的 4 个 sp3杂化轨道间的夹角为 109°28',所以生成的
时 ,在 H 的影响下,C 的 1 个 2S轨 道 和 3 个 2 p 轨道进行sp3杂化,形 成 4 个 sp3杂化轨道,每 个 Sp3杂化轨道中各有一个未成对电子。C 用 4 个 Sp3杂化轨道分 别与4 个 H 的 1 s 轨 道 重 叠 形 成 4 个σ 键。由 于 C 的 4 个 sp3杂化轨道间的夹角为 109°28',所以生成的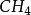 的几何构型为正四面体。2
的几何构型为正四面体。2
注意事项(1)原子轨道的杂化只有在形成分子的过程中才会发生;
(2)能量相近的原子轨道间才能发生杂化,能量相近通常是指:ns与np、ns,np与nd或(n-1)d。1
本词条内容贡献者为:
杨剑虹 - 教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国