永停滴定法(dead-stop titration)又称为双电流或双安培滴定法。它是根据滴定过程中电流的变化确定滴定终点的方法。它操作简单,确定终点方便快捷。
定义永停滴定法(dead-stoptitration),又称双安培滴定法(doubleamperometrictitration),或双电流滴定法,是根据滴定过程中外加小电压下,溶液里有可逆电对就有电流,无可逆电对就无电流的现象确定滴定终点的方法,属于一种电化学分析法。1
测量方法采用两支相同的铂电极,当在电极间加一低电压(例如50mV)时,若电极在溶液中极化,则在未到滴定终点时,仅有很小或无电流通过;但当到达终点时,滴定液略有过剩,使电极去极化,溶液中即有电流通过,电流计指针突然偏转,不再回复。反之,若电极由去极化变为极化,则电流计指针从有偏转回到零点,也不再变动。根据滴定剂和被滴溶液所采用电对的可逆性,观察滴定过程中电流指针的变化来判断滴定终点(即指针突变点)。必要时也可以记录加入标准溶液的体积(V)和相应的电流(I),绘制I-V滴定曲线来确定滴定终点。1
滴定曲线及终点判断可逆电对在氧化还原反应的任一瞬间都能建立氧化还原平衡并且表现出符合能斯特方程式理论电位相符合的实际电极电位,如: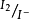 ,
,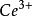 /
/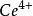 ,
,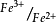 等;反之,不可逆电对不能在任一瞬间建立起氧化还原平衡,并且表现出不符合能斯特方程式理论电位相符合的实际电极电位,如:
等;反之,不可逆电对不能在任一瞬间建立起氧化还原平衡,并且表现出不符合能斯特方程式理论电位相符合的实际电极电位,如: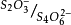 ,
,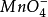 /
/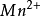 ;
;
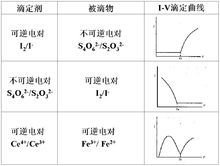
可逆电对滴定不可逆电对例如:用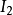 滴定硫代硫酸钠,氧化还原反应为:
滴定硫代硫酸钠,氧化还原反应为: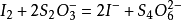 。在化学计量点之前,溶液里只有碘离子和
。在化学计量点之前,溶液里只有碘离子和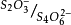 不可逆电对,不存在电流。此时电流计的指针停留在接近0电流的位置。当化学计量点后,加入稍过量的
不可逆电对,不存在电流。此时电流计的指针停留在接近0电流的位置。当化学计量点后,加入稍过量的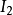 ,溶液里便有了
,溶液里便有了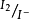 可逆电对形成,电极上发生电解反应生成了电流,且电流强度随着
可逆电对形成,电极上发生电解反应生成了电流,且电流强度随着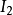 过量浓度的增大而增大,电流计指针偏转。这种类型的滴定是以电流计指针停留在0附近发生偏转并不再回至原位为滴定终点。
过量浓度的增大而增大,电流计指针偏转。这种类型的滴定是以电流计指针停留在0附近发生偏转并不再回至原位为滴定终点。
不可逆电对滴定可逆电对例如:用硫代硫酸钠滴定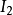 ,氧化还原反应为:
,氧化还原反应为: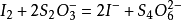 。在化学计量点之前,溶液里有
。在化学计量点之前,溶液里有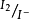 可逆电对,存在电流。随着滴定的进行,
可逆电对,存在电流。随着滴定的进行,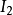 的浓度逐渐变小,电流也逐渐减小。当化学计量点时,降到0;计量点后,加入稍过量的硫代硫酸钠,溶液里只有
的浓度逐渐变小,电流也逐渐减小。当化学计量点时,降到0;计量点后,加入稍过量的硫代硫酸钠,溶液里只有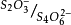 不可逆电对,电流计指针停留在0。这种类型的滴定是以电流计指针突然下降至0并不再改变为滴定终点。
不可逆电对,电流计指针停留在0。这种类型的滴定是以电流计指针突然下降至0并不再改变为滴定终点。
可逆电对滴定可逆电对例如: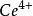 滴定
滴定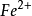 ,氧化还原反应为:
,氧化还原反应为: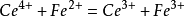 .滴定之前,溶液里只有亚铁离子,而没有铁离子,无电流;滴定开始后,随着
.滴定之前,溶液里只有亚铁离子,而没有铁离子,无电流;滴定开始后,随着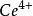 的加入生成了铁离子,形成了
的加入生成了铁离子,形成了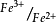 可逆电对,产生电流,而且随着滴定进行,铁离子浓度越来越大,电流越来越大,当铁离子浓度等于亚铁离子浓度时,电流最大,随后随着滴定加入,电流一直减少;化学计量点时,溶液里几乎无亚铁离子,电流降到最低;计量点之后,过量的
可逆电对,产生电流,而且随着滴定进行,铁离子浓度越来越大,电流越来越大,当铁离子浓度等于亚铁离子浓度时,电流最大,随后随着滴定加入,电流一直减少;化学计量点时,溶液里几乎无亚铁离子,电流降到最低;计量点之后,过量的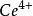 与溶液里的
与溶液里的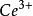 组成了
组成了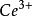 /
/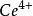 可逆电对,电流又重新产生。1
可逆电对,电流又重新产生。1
应用简便易行,准确可靠,广泛用于药物分析中。karl Fischer法测定药物微量水分时常采用永停滴定法。永停滴定法确定重氮化滴定的终点,比用外指示剂法或内指示剂法准确度高。123
本词条内容贡献者为:
代祥光 - 副教授 - 西南大学电子信息工程学院




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国