分子内亲核取代反应(internal nucleophilic substitution)用SNi表示,其中S代表取代,N代表亲核,i代表分子内。
背景知识有机反应类型分类根据共价键断裂的方式,有机化学反应可以分为协同反应,自由基反应,离子型反应。
协同反应:在反应过程中,旧键的断裂和新键的形成都相互协调地在同一步骤中完成的反应称为协同反应。协同反应往往有一个环状过渡态。它事一种基元反应。
自由基型反应: 由于分子经过均裂产生自由基而引发的反应称为自由基型反应。自由基型反应分链引发、链转移和链终止三个阶段。
离子型反应:出分子经过异裂生成离子而引发的反应称为离子型反应 。 离子型反应有亲核反应和亲电反应。 由亲核试剂进攻而发生的反应称为亲核反应,亲核试剂是对正原子核有显著亲和力而起反应的试剂。由亲电试剂进攻而发生的反应称为亲电反应。而亲核以及亲电反应又可以进一步分为加成反应和取代反应。
反应物与试剂反应物和试剂之间没有十分严格的界限,是个相对的概念、 惯用语。本来相互作用的两种物质,即可互为反应物, 也可互为试剂。但为了讨论和研究问题时方便,从经验中人为的规定反应中的一种有机物为反应物,无机物或另一种有机物为试剂。1
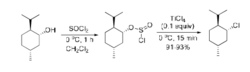
分子内亲核取代反应历程分子内亲核取代反应(internalnucleophilicsubstitution)用SNi表示,其中S代表取代,N代表亲核,i代表分子内。在上述醇与二氯亚砜作用生成氯代烷的反应中,若在无溶剂条件下进行,或在非亲核性溶剂(如二氯甲烷)中进行,反应也得到构型保持的氯代产物。在此情况下,反应按照SNi机理进行,而不是两次SN2过程。
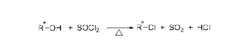
反应首先形成氯亚磺酸酯,氯亚磺酰酯在加热分解时通过一个协同的四元环过渡态,一步生成构型保持的氯代烷(patha),或先生成离子对,然后,离去基团作亲核试剂,同面进攻碳正离子,生成构型保持的产物(pathb)。这两个机理目前尚存争论。1
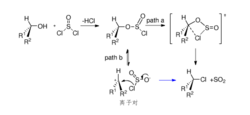
前沿研究最近报道,四氯化钛可催化醇与二氯亚砜的反应。在二氯甲烷溶剂中,醇二氯亚砜先生成氯亚磺酸酯,后者在催化量的四氯化钛存在下转化为构型保持的氯化物,例如:1
相关知识-其他两种亲核取代反应发生在卤代烷、醇、磺酸酯等有机化合物的饱和碳原子上的亲核取代主要有两种机理,即单分子亲核取代反应(用SN1表示)和双分子亲核取代反应(用SN2表示),其中S代表取代(substitution),N代表亲核(nucleophilic),1代表单分子,2代表双分子。
单分子亲核取代反应以叔丁基氯的水解为例:反应分步进行。首先C‐Cl键发生异裂生成碳正离子和氯负离子,碳正离子接受溶剂的亲核进攻,生成质子化的醇,和水发生质子交换最后得到醇。反应发生在饱和碳原子,即sp3碳原子上,净结果是氯被羟基所取代,水作为亲核试剂进攻到碳原子上,因此,称为饱和碳原子上的亲核取代。反应的决速步骤是C‐Cl键的异裂,反应速度只和叔丁基氯的浓度有关,和亲核试剂的浓度无关,因此,是单分子反应动力学。总体上讲,该反应称为饱和碳原子上单分子亲核取代反应,即SN1反应。
反应的决速步骤是C‐X键的异裂,因此,离去基团对SN1反应速度的影响如下,氟代烃不能作为SN1反应的底物:R-I > R-Br > R-Cl。SN1反应为单分子反应动力学,反应速度只和底物的浓度有关,和亲核试剂的浓度无关,因此,亲核性的强弱对SN1反应无影响。碳正离子是一个平面结构,亲核试剂从可以平面的两侧进攻碳正离子,理论上产物是一对对映体,没有立体选择性。多数情况下,SN1反应优先得到构型翻转的产物。这可从离子对理论进行解释。离子对理论认为,C-X键的异裂经过紧密离子对、溶剂间隔离子对,最后成为自由的碳正离子。只有自由的碳正离子才是以均等的几率接受亲核试剂的两面进攻。亲核试剂进攻底物、紧密离子对、溶剂间隔离子对时,都是从离去基团的反面进行进攻。因此,主要产物为构型翻转的产物。
双分子亲核取代反应与SN1反应相对应,SN2反应中,亲核试剂带着一对孤对电子进攻具亲电性的缺电子中心原子,形成过渡态的同时,离去基团离去。反应中不生成碳正离子,速率控制步骤是上述的协同步骤,反应速率与两种物质的浓度成正比,因此称为双分子亲核取代反应。无机化学中,常称双分子亲核取代反应类型的反应机理为“交换机理”。SN2反应最常发生在脂肪族sp3杂化的碳原子上,碳原子与一个电负性强、稳定的离去基团(-X)相连,一般为卤素阴离子。亲核试剂(Nu)从离去基团的正后方进攻碳原子,Nu-C-X角度为180°,以使其孤对电子与C-X键的σ反键轨道可以达到最大重叠。然后形成一个五配位的反应过渡态,碳约为sp2杂化,用两个垂直于平面的p轨道分别与离去基团和亲核试剂成键。C-X的断裂与新的C-Nu键的形成是同时的,-X很快离去,形成含C-Nu键的新化合物。
SN2反应一般发生在伯碳原子上,很难成为有位阻分子的反应机理,并且取代基越多,按SN2机理反应的可能性越小。基团在空间上比较拥挤的分子一般采用SN1机理,可以缓解一部分的位阻,也可生成较稳定的碳正离子(通常为三级碳正离子)。由于亲核试剂是从离去基团的背面进攻,故如果受进攻的原子具有手性,则反应后手性原子的立体化学发生构型翻转,也称“瓦尔登翻转”。这也是SN2反应在立体化学上的重要特征。反应过程类似于大风将雨伞由里向外翻转。1
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国