芳环亲核取代中最重要的是按如下机理进行的反应:亲核试剂先加到芳环上形成一个碳负离子活泼中间体,其负电荷是离域的。然后这个中间体失去一个负离子,恢复稳定的芳环结构,生成亲核取代产物。因反应机理的第一步是亲核试剂对芳环的不饱和键加成,第二步是中间体脱除一个基团再形成不饱和键,故常称之为加成消除机理。
简介芳烃不容易发生这种亲核取代,只有当环上有强吸电子基时,反应才能进行,或比较容易进行。
例如直接由苯与碱作用不能得到苯酚,但将硝基苯与粉状KOH共热,可以发生硝基的邻位或对位氢被羟基取代而生成相应硝基酚的取代反应。OH-进攻硝基的邻位或对位时,形成的活泼中间体的负电荷可被硝基进一步分散。硝基的这种作用,以对位取代为例,可用共振结构式表示如下:1
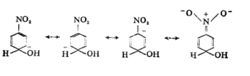
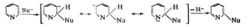
如果OH-进攻间位,硝基就起不了这种作用。在这种亲核取代中,从芳环上离去的是碱性很强很不稳定的H-,所以反应的进行并不是很容易的,反应收率一般不高。如果丛芳环上离去的不是H-,而是比较稳定的负离子(如卤负离子),反应就会比较顺利。例如邻、对位有硝基的氯苯,其氯原子能比较顺利地被多种亲核基团所取代。六元含氮杂环由于环上电荷密度低,比较容易发生亲核取代。毗啶就比苯容易得多。主要生成α-位或γ-位取代产物。以α位取代为例,反应机理可如下表示:
羧基碳上加成消除机理羧酸中的羰基表现出与醛,酮中的羰基类似的反应性;碳的亲核进攻和氡的亲电进攻。然而,羧基结构中OH基团的存在使得羧酸有着另一方面的化学性质。如同在醇中一样,这个OH可被转变成离去基团。结果是,在羰基碳的亲核加成发生后,离去基团离去,导致净的取代过程和新的羰基化合物的生成。
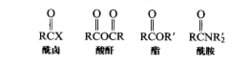
羰基碳受到亲核进攻羰基碳是亲电性的,可能被亲核剂进攻。在羧酸和羧酸衍生物(具有通式RCOL的底物,其中L代表离去基团)中观察到了这类反应性。
与醛和酮的加成产物不同,羧基碳上亲核进攻形成的中间体通过消除一个离去基团而分解。总的结果是亲核剂通过所谓的加成消除过程而取代离去基团。在此转化中首先形成的物种含有一个四面体的碳中心(与原料及产物不同),因此它被称为四面体中间体。
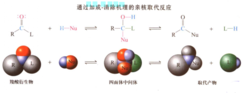
通过加成消除机理的亲核取代反应,是羧酸衍生物及其互相转变的重要途径。2
酸或碱催化加成消除机理在酸或碱催化下,羧酸衍生物可发生类似于酯化反应的亲核取代反应,离去基团被亲核试剂取代,反应按加成一消除机理进行。以酸催化为例:
在酸催化下,反应涉及以下五个步骤:3
第一步:质子化活化羰基。
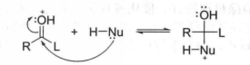
第二步:亲核试剂(HNu)对质子化的羰基进行亲核加成。

第三步:质子转移至离去基团(L),离去基团被活化。

第四步:离去基团离去。
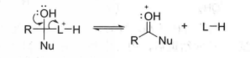
第五步:脱去质子,得到亲核取代产物。
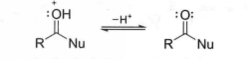
羧酸衍生物羰基上的亲核进攻,是加成消除机理取代反应中的一个关键步骤。酸或碱都可催化此反应。对于羧酸而言,由于不良的离去基团(氢氧根) 和酸被亲核剂(作为碱)的竞争性去质子化,从而使过程变得复杂。用弱碱性的亲核剂,加成能够发生。
相关扩展消除加成机理:
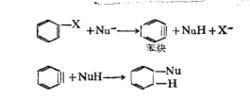
环上没有强吸电子基的卤代芳烃与氢氡化钠水溶液共热,难以发生亲核取代反应。但是在强烈的反应条件下立或者用碱性极强的试剂(如NaNH2/液NH3)还是可以发生卤原子被取代的反应的。在这样的条件下,反应是按消除加成机理,或称苯炔机理进行的。
本词条内容贡献者为:
李廉 - 副教授 - 中国矿业大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国