低温即指低于室温的温度。将物质的温度降到低于环境温度的操作称为制冷或冷冻。一般说来,将局部空间温度降低到一100℃称为普通冷冻或普冷;降低到一100℃至4.2 K之间称为深度冷冻或深冷;降低到4.2 K以下者称为极冷。室温以下的合成成为低温合成
低温的获取恒温低温浴低温合成需要一定低温源装置,可分为制冷浴与相变制冷浴。常用的制冷浴有冰盐共熔体系(将冰块和盐按一定比例混合可达较低温度,如下表)、干冰浴、液氦浴等。相变制冷浴可以恒定温度,如液氨等。
|| || 常用冷浴
制冷产生低温在现代低温试验中,通常利用液化气体、微型制冷及超低温技术等手段获取低温。下表列出了获取低温的各种方法及目前所达到的最低温度。现在有很多大型的超低温制冷装置。
|| || 获取低温的基本方法及目前所达到的最低温度
低温恒温器低温恒温器是一种在指定的温度下,为延长时间周期而能自动控制的机械装置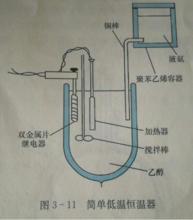 如右下图所示,它的制冷是通过一根铜棒进行的,铜棒作为冷源,其一端同液氨接触,借铜棒浸入液氨的深度调节温度,目的是使冷浴温度比所使冷浴温度比所要求的温度低5℃ 左右,另外有一个控制加热器的开关,经冷热调节可使温度保持在恒定温度士0.1℃。所示是用于可达一150℃的简单气浴低温恒温器。它用冷的氮气流作为冷源。当温度低于所要求的温度时,电磁阀关闭,气流通过针形阀的速度相对地减小,这时恒温器的温度升高。当温度高于所要求的温度时,双金属热敏开关打开电磁阀,较快的气流就会使装置冷却下来。但是,由于这种低温恒温器热容量很低,为使浴中的物体达到热平衡,需要较长的时间。1
如右下图所示,它的制冷是通过一根铜棒进行的,铜棒作为冷源,其一端同液氨接触,借铜棒浸入液氨的深度调节温度,目的是使冷浴温度比所使冷浴温度比所要求的温度低5℃ 左右,另外有一个控制加热器的开关,经冷热调节可使温度保持在恒定温度士0.1℃。所示是用于可达一150℃的简单气浴低温恒温器。它用冷的氮气流作为冷源。当温度低于所要求的温度时,电磁阀关闭,气流通过针形阀的速度相对地减小,这时恒温器的温度升高。当温度高于所要求的温度时,双金属热敏开关打开电磁阀,较快的气流就会使装置冷却下来。但是,由于这种低温恒温器热容量很低,为使浴中的物体达到热平衡,需要较长的时间。1
低温合成实例(1)非水溶剂中的低温合成
许多在非水溶剂中进行的反应必须在低温下进行,因为它们只在低温下才呈液体状态,如NH3、SO2、HF等,其中液氨是研究得最多,也是应用最广的非水溶剂。例如:
液氨体系: Mg+2NH3(l)═══Mg(NH2)2 ↓+H2↑
液态S02体系:CaO+2S02(l)═══CaS205
PCI5+S02(l)═══POCl3+SOCl2
(2)低温下稀有气体化合物的合成
稀有气体是氦、氖、氩、氪、氙、氡等六种元素的总称。稀有气体混合物本身就是在低温下进行分离和提纯的,它们的一些化合物也是在低温下合成的,常采用的方法有低温放电合成、低温水解合成和低温光化学合成。例如:
低温放电合成:2F2+SICl4+2Xe ═══2XeCl2+SiF4
低温水解合成: XeOF4+2H20═══Xe03+4HF
低温光化学合成: Xe+F2═══XeF2
(3)低温下挥发性化合物的合成
挥发性化合物由于其熔点、沸点都较低,且合成时副反应较多,因此它的合成与纯化都需在低温下进行。如在低温条件下以丙二酸为原料制备二氧化三碳:
C3H404 ═════════C302+2H20
低温合成技术的应用稀有气体化合物的合成稀有气体是氦、氖、氩、氪、氙等六种元素的总称,旧称“惰性气体”。稀有气体本身就是在低温下进分离、纯化的,而且它的些化合物也是在低温下合成的。自从20世纪60年代首次合成氙的化合物后,又陆续合成了许多新的稀有气体化合物。现就低温的主要合成方法归纳如下:
a.低温下的放电合成
约斯特(Yost)等人于1933 年曾用放电法制备氟化氙,但未成功。基甚谢思鲍姆(Kirschenbaum)等人于1963 年用放电祛制备XeF4获得成功。反应器的直径为6.5cm,电极表面的直径为2cm,相距7.5cm,将反应器浸人-78℃的冷却槽中,然后将1体积的氙和2 体积的氟在常温常压下以136cm3/h的速度通人反应器;放电条件为(1100V,31mA)~(2 80 V,12mA)。历时3h,耗14.20mmol氟和7.1mmol氙,生成了7.07mmol( 1.465g)的氟化氙。说明此反应为定量反应。为了测定产物的组成,用过量的汞和产物反应,生成HgF 并放出氙,证明产XeF4。反应按下式进行:XeF4+ 4Hg═══Xe+2Hg2F2
在低温下XeF4与过量的O2F2反应时,则可被氧化成XeF6其反应为:
XeF4+02F2 ——→ XeF6+O2(在140K~195K温度下)
低温放电合成的另个例子是二氯化氙(XeCl2)的制备。于-80℃ 下在氙、氯、SiCl4(或CCl4) 混合物中进行高频放电,得到白色晶体。此白色晶体较稳定,可长期存放在密封的玻璃容器中。在室温下通过减压升华可使之纯化。但在高度真空下,或加热至80℃,结晶即分解,质谱分析时观察到XeCl+ 离子,推测此白色晶体是XeCl2但未能进行化学分析。也有人在氙、氯混合物中进行微波放电,将产物收集在2 K 的冷阱中,随即对产物作红外吸收光谱测定,在313cm-1处显示一吸收峰。若假定XeCl2分子的几何构型是线形对称的,则计算出来的红外吸收光谱与实验所得值接近(计算值314.1cm -1)。说明此吸收峰相应于线状分子XeCl2的振动。从而证实微波放电后的产物确是XeCl2。
b .低温水解合成
迄今为止,氙的氧化物尚不能由单质的氤和氧直接化合而成,只能由氟化氙转化而来,氙的氟氧化物也是靠氟化氙转化而获得。如XeO3,XeOF4,XeO2F2是由XeF6转化而来,XeO4 和XeO2F2 则由XeF4或XeF6水解生成高氙酸再转化而成。
最初制成XeF4时,就发现它的水解过程比较复杂。经过仔细研究,证明水解的最终产物不是Xe(Ⅳ)化合物,而是Xe(Ⅵ)化合物。其反应机理为XeF4水解时发生歧化反应,Xe(Ⅳ)一部分被氧化成Xe(Ⅵ)一部分被还原为单质氙。
3XeF4+6H2O═══2XeO+ XeO4 +12HF Xe0═══Xe + 1/2 O2
XeO4═══XeO3+1/2 O2
故总的反应式为: 8XeF4+6H2O═══XeO3+2Xe+ 1/2O2 +12HF
水解的最终产物经X 射线分析,确证为XeO3 。
XeF6 的水解机理比较简单,无歧化反应产生: XeF6+ 3H2O═══XeO3+6HF
此外XeOF4 水解也可生成XeO3: XeOF4+2H2O═══XeO3 + 4HF
对比XeF4和XeF6的水解结果可以看出,XeF6水解时Xe(Ⅳ)全部变成XeO3转化率最高;XeF4由于歧化反应,Xe(Ⅳ)只有1/3 转化为XeO3,故制备XeO3, 以XeF6水解为宜。
XeF4和XeF6的水解反应极为剧烈,易引起爆炸。为了减慢和便于控制反应速度,可先用液氮冷却氟化氙,然后加人水,这时便形成了凝固状态,逐渐加热使反应缓缓进行.直至加热至室温。水解完毕后,小心地蒸发掉氟化氢和过量的水,便可得到潮解状的白色XeO3固体。
XeO4的制备也需要低温,将高低酸盐放人带支管的玻璃仪器中,在室温下缓慢滴入-5℃ 的浓硫酸,则生成XeO4气体。将此气体收集在液氮冷凝器中,呈黄色固体。然后进行真空升华,即得到纯的四氧化氙,储于-78℃的冷凝容器中。高氙酸盐与浓硫酸的反应如下:
Na4XeO6+2H2SO4 ═══XeO4+2Na2SO4+2H2O
Ba2XeO6+2H2S04 ═══ XeO4+2BaSO4↓+2H2O
需要特别指出的是XeO4固体极不稳定,甚至在-40℃也发生爆炸,其反应式为:
Xe04═══Xe +202
因此需要在-78℃下保存。气态的XeO4反而比较稳定,在室温或稍高于室温的温度下徐徐分解为XeO3。
c.低温光化学合成
Weeks 等于1962年在一600 下用紫外线照射氪氟混合物,没有得到氟化氪,Streng于1966年将氪和氟(或F2O)按1:1摩尔比装人硬质玻璃容器中,在常通常压下,用日光照射五个星期,据信制得了KrF2,但此实验未能被重复,趋向于被否定。这样,光化学合成法制备KrF2就搁置下来。至1975年Slivnik降低反应温度至-196℃在100mL的硬质玻璃反应器内,用紫外线照射氪、氟混合液体48h,确证获得了4.7gKrF2。实验证明温度对反应的影响很显著;温度稍高就不能合成KrF2。侧如,在-787℃时,氪、氟混合物在紫外线(200~470nm)展射下,不能生成氟化氪,这也就解释了早期用光化学法合成氟化氪失败的原因。因为早期时的温度为-60℃和室温,高-78℃,故不生成二氟化氪。
光化学合成KrF2的机理,首先是分子氟受激分解为原子氟,原子氟与氪生成KrF**·自由基,然后KrF·和KrF·或F原子碰撞生成KrF2;故光源的波长对量子产率(KrF2的产量/W·h)有很大的影响。
例如,310nm时的量子产率最大。这是因为氟分子的吸收带恰好在250~300nm区间,有利于氟受激分解为原子氟。体系中的杂质对量子产率的影响也很大。例如,在Kr(s)~F2((g)体系中,如含氧10%-15%则量子产事降低1~2倍,低的影响更大,当体系中含氙5%时,实际上不生成KrF2,主要生成XeF2,加BF3,可使量子产率增加一倍,这可能是BF3与KrF·自由基反应,生成的KrBF4,有利于KrF·的稳定和不致分解;另方面,BF3与生成KrF3,结合为KrF2·**BF3可免于KrF2的光解。
氡在低温下也可与某些氟化剂生成氟化氡。例如将浓度较大的氡与液态氟和固态CIF3在-195℃反应,可获得非挥发性的氟化氡。氡在-160℃至-40℃的低温下,可被O2F2氟化为氟化氡,经X射线分析,确定产物除RnF2外,还有微量的RnF4
与氟化氯相比,氟化氡的稳定性要好的多,其在500℃才能被氡还原为单质氡,而XeF2,XeF4,XeF6被氡还原的温度分别为400℃,130℃和室温。
氟化氡在酸性或碱性溶液中水解时,氡气都全部释放出来,在溶液中不留下任何氡的化合物,这是和氟化氙截然不同。
低温分离非金属化合物的反应由于存在一个化学平衡而不可能反应完全,加之副反应较多,所以所得的产物往往是一个混合物。混合物的分高主要根据它们的沸点不同通过低温来进行。低温分离的方法主要有四种,低温下的分级冷拟;低温下的分级减压燕发;低温吸附分离;低温化学分离。
(1)低温下的分级冷凝
通常认为,低温下的分级冷凝是使气体混合物通过同低温的冷阱,由于气体的沸点不同,就会分别冷凝在不同低温的冷阱内,从而达到分离目的,当有种气体通过冷阱后其蒸气压小于1.3Pa,就认为是定量地捕集在冷阱中,是冷能彻底了;而蒸气压大于133.3Pa的气体能穿过冷阱,就认为不能冷聚。
选择这种操作时要让意,混合气体通过冷阱时的速度不能太快,否则分离效率受影响;还要注意的是当混合物中各组分沸点之差小于40℃ 时,通过分级冷疑达不到定量的分离,但可通过重复的分级冷拟实现分离。
(2)低温下的分级减压蒸发
这是分离两种沸点之差大于80℃挥发物质最简单的方法。使用右图所示的装置,将欲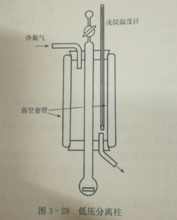 分离物装在下部浸人液氨的玻璃泡中,让冷氮气流经真空套管夹套,使温度保持在-130℃左右,让混合物升温回流,减小冷氮气流,使夹套升温直至易挥发组分被泵抽走。
分离物装在下部浸人液氨的玻璃泡中,让冷氮气流经真空套管夹套,使温度保持在-130℃左右,让混合物升温回流,减小冷氮气流,使夹套升温直至易挥发组分被泵抽走。
(3)低温吸附分离
从热力学可知,物理吸附过程中吸附是放热的。因此,吸附量将随温度的升高而降低。但当气体吸附质分子(如N2、Ar、CO等)的大小与吸附剂的孔径接近时,温度对吸附量的影响就会出现特殊情况。
(4)低温化学分离
当两种化合物通过其挥发性的差别进行分离达 不到理想结果时,可以加人过量的第三种化合物,第三种化合物能与其中一种形成不挥发性的化合物,这样把打发性的组分除去之后,再向不挥发性产物中加人过量的第四种化合物。这第四种化合物可以从不挥发性化合物中把原来的组分置换出来,同先前加入的第三种化合物形成不挥发性的化合物,例如,SF4的低温纯化就是个典型例子。2
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国