标准摩尔反应焓变是指参加反应的各物质都处于标准态时的反应焓变。热力学是无机化学课程的重要组成部分,它是以热力学第一定律、热力学第二定律、热力学第三定律为基础,主要解决化学反应中能量转化及化学反应进行的方向和程度问题,其中焓变计算是解决等压情况下反应中能量转化问题、进行吉布斯自由能变变计算进而判断反应进行程度和方向的基础。
理论基础标准摩尔反应焓变是指参加反应的各物质都处于标准态时的反应焓变,记为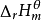 ,单位为kJ/mol。
,单位为kJ/mol。
计算标准摩尔反应焓变的理论基础是Hess定律,即在恒容或恒压条件下,一个化学反应不论是一步完成或分几步完成,其反应热(即摩尔反应焓变)完全相同。
Hess定律的实质是指出了反应只取决于物质的初、终状态,而与经历的具体途径无关。其重要意义在于能使热化学方程式像代数方程式一样进行加、减运算,从而可以应用已知化学反应的热效应,间接算得未知化学反应的热效应,解决那些难以测量或根本不能测量的反应热效应问题。应用时要注意:将已知的热化学方程式进行线性组合的结果必须与欲求的未知化学反应的状态完全相同,包括温度、压力及各物质的相态,并且这些化学反应都是在等温、等压或等温、等容条件下进行的,都不做其他功能。
焓的绝对值是无法确定的,但可以采用相对焓值。焓是状态函数,状态函数的最主要特点是其变化值只取决于系统的始态和终态,而与系统变化的途径无关。因此,以Hess定律为理论基础,可以求得反应的摩尔焓变。1
相关定义标准摩尔生成焓在温度为T的标准态下,由稳定相态的单质生成1mol的β相态的化合物B(β),该生成反应的焓变即为该化合物B(β)在温度T时的标准摩尔生成焓,记为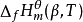 ,单位为kJ/mol。
,单位为kJ/mol。
生成焓仅是个相对值,相对于稳定单质的焓值等于零。
标准摩尔燃烧焓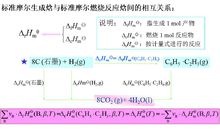 在温度为T的标准态下,1mol的β相态的物质B(β)与氧进行完全氧化反应时,该生成反应的焓变即为该物质B(β)在温度T时的标准摩尔燃烧焓,记为
在温度为T的标准态下,1mol的β相态的物质B(β)与氧进行完全氧化反应时,该生成反应的焓变即为该物质B(β)在温度T时的标准摩尔燃烧焓,记为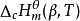 ,单位为kJ/mol。
,单位为kJ/mol。
“完全氧化”是指在没有催化剂作用下的自然燃烧。规定的指定产物不同,焓变值也不同。2
以上二者的关系如图。
标准摩尔反应焓变的计算方法利用热化学方程式的组合计算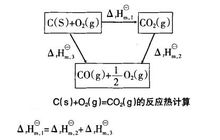 已知一些分反应的标准摩尔反应焓变,利用热方程式的组合可以求得总反应的标准摩尔反应焓变。
已知一些分反应的标准摩尔反应焓变,利用热方程式的组合可以求得总反应的标准摩尔反应焓变。
例如计算碳和氧气反应生成CO2的反应焓变。碳和氧可以一步直接生成CO2,也可以先生成CO,再使CO与氧气继续反应生成CO2,根据Hess定律,这二种途径的反应热效应是完全相同的。如图所示。
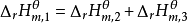 ;
;
即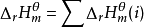 。
。
需要注意的是:在方程式的组合过程中,把相同物质消去时,不仅物质种类必须相同,而且状态也要相同,否则不能相消。2
利用标准摩尔生成焓计算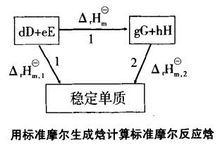 对任一化学反应,利用各种反应物和生成物的标准摩尔生成焓变的数据,就可以求得该反应的标准摩尔反应焓变
对任一化学反应,利用各种反应物和生成物的标准摩尔生成焓变的数据,就可以求得该反应的标准摩尔反应焓变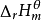 。物质的标准摩尔生成焓变的数值可从各种化学、化工手册或热力学数据手册中查到。
。物质的标准摩尔生成焓变的数值可从各种化学、化工手册或热力学数据手册中查到。
可以通过设置路径来计算反应的摩尔焓变。对任何一个化学反应来说,其反应物和生成物的原子种类和个数是相同的,因此可以用同样的稳定单质来生成反应物和生成物。例如对反应dD+eE=gG+hH,设置路径如图。
根据Hess定律,若把参加反应的各稳定单质定为始态,把反应的生成物定为终态,则途径1和途径2的反应焓变应相等,所以: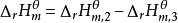 ;
;
因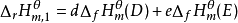 ,
,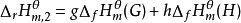 ;
;
所以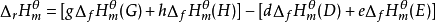 ;
;
即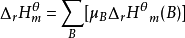 。
。
即一定温度下,化学反应的标准摩尔反应焓变,等于同温度下产物的标准摩尔生成焓之和减去反应物的标准摩尔生成焓之和。1
利用标准摩尔燃烧焓计算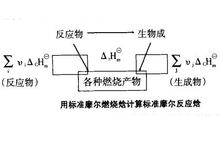 有机物难于直接从单质合成,其标准摩尔生成焓数据难以得到,但有机物容易燃烧,可利用燃烧焓的数据来求算某些反应的焓变。对于一个化学反应来说,其反应物和生成物的原子种类和数目相同,它们完全燃烧的产物也势必相同。可设置路径如图所示。
有机物难于直接从单质合成,其标准摩尔生成焓数据难以得到,但有机物容易燃烧,可利用燃烧焓的数据来求算某些反应的焓变。对于一个化学反应来说,其反应物和生成物的原子种类和数目相同,它们完全燃烧的产物也势必相同。可设置路径如图所示。
根据Hess定律,若把反应物作为始态,燃烧产物作为终态,则:
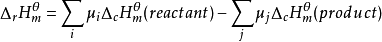 。
。
即化学反应的标准摩尔焓变等于反应物的标准摩尔燃烧焓之和减去产物的标准摩尔燃烧焓之和。
利用水合离子的标准摩尔生成焓计算对于水溶液中有离子参加的反应,如果知道水合离子的标准摩尔生成焓,就可求得该反应的标准摩尔反应焓变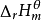 。由于离子都是成对存在的,无法测定单一离子的生成焓,为此必须规定一个相对标准,在此基础上求得其他水合离子生成焓的相对值。因此人为地规定氢离子的标准摩尔生成焓为零,即
。由于离子都是成对存在的,无法测定单一离子的生成焓,为此必须规定一个相对标准,在此基础上求得其他水合离子生成焓的相对值。因此人为地规定氢离子的标准摩尔生成焓为零,即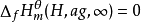 ,由此可以获得其他水合离子生成焓的相对值。可按下式计算反应焓变:
,由此可以获得其他水合离子生成焓的相对值。可按下式计算反应焓变: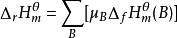 。
。
利用键能估算对于那些缺少标准摩尔生成焓数据的反应,可由键能来近似计算反应的焓变。键能计算反应焓变只适用于气相反应,有固体或液体参加的反应,不能直接用键能来计算其反应焓变,而应该将固体或液体先变成气体,然后才能进行计算。
由键能计算所得的数值准确度并不高,这是由键能数据本身的局限性所决定的。对双原子分子而言,键能就是键的解离能。对多原子分子,键能实际上是平均键能。用键能可估算化合物的标准摩尔生成焓变。可以假设这样一个过程,即将稳定单分子的键断开成为气态原子,然后再将气态原子组合成这个化合物的各种键。
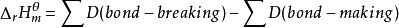 。
。
即气相反应的焓变等于破坏键所需要的能量之和减去形成键所放出的能量之和。或者气相反应的焓变等于反应物的键能之和减去产物的键能之和: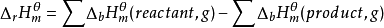 。
。
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国