烯醇内酯与格式试剂反应生成环状α-取代-α,β-不饱和酮。是对Robinson环化反应的另一种选择。
Robinson反应:含活泼亚甲基的环酮与a,b-不饱和羰基化合物在碱存在下反应,形成一个二并六元环的环系。
反应机理
δ-烯醇内酯与格氏试剂作用,然后发生分子内羟醛缩合,得到五、六元环的双环α,β-不饱和酮。反应以日裔美国化学家 George I. Fujimoto 和加拿大化学家 Bernard Belleau 的名字命名。整个过程产率很好。用于甾类化学。所形成的环己烯酮在甲醇中与碘反应可得苯甲醚衍生物。
机理如图所示。包括格氏反应、质子交换和分子内羟醛缩合(消除为E1cB机理)三步。
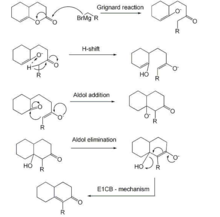
反应中,先由碱夺取底物离去基团的β-氢生成碳负离子(共轭碱),然后该共轭碱的离去基团离开,生成烯烃。E1cb反应是反式共平面的消除反应。
第一步反应为平衡反应,其速率较快,使底物很快与其共轭碱形成平衡。
第二步为总反应的速率控制步骤,是较慢的一步。总反应的速率控制步骤只与一个分子有关,是单分子过程,因此称为“E1”反应。但是与E1反应相比,此类反应中发生消除的不是底物分子,而是底物的共轭碱,因此记为“E1cB反应”,全称“单分子共轭碱消除反应”。
具有以下特点的物质容易发生E1cB反应:
1)β-碳原子上连有强的吸电子基,从而使β氢具有较强的酸性,使碳负离子得以稳定。
2)离去基团难以离去。1
反应举例
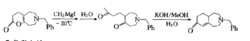
罗宾森增环反应
罗宾森增环反应,该反应于1935年由英国R.罗宾森首先发现。是在碱的催化作用下,环己酮及其衍生物与曼尼期碱的季铵盐作用,生成双环α,β-不饱和酮的反应。
在碱的催化作用下,环酮与甲基乙烯酮或其等价化合物作用,生成双环α,β-不饱和酮的反应。该反应于1935年由英国R.罗宾森首先发现。
该反应最大的特点就是在一环上形成了一个新的六元环,形成二环结构。除此特点之外,该反应还可以在两个环相稠合的碳原子上引入角甲基,角甲基是指两个环共用碳上的甲基,这个甲基很难用其它方法引入,很多药物如睾丸酮激素等有角甲基结构,可通过此法引入。罗宾森增环反应常用的碱性试剂有氨基钠、乙醇钠和叔丁醇钾等。由于甲基乙烯酮容易发生聚合反应,实际应用时常以其前身曼尼希碱季铵盐代替。后者在碱性条件下容易分解而转变为甲基乙烯酮:新生的甲基乙烯酮无需分离出来,立即可参加反应。2
本词条内容贡献者为:
曹慧慧 - 副教授 - 中国矿业大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国