1693 年,康熙 39 岁那年,突然罹患疟疾,反复不断的寒战和高烧令他痛苦万分。其实北京天干物燥,原本不是疟疾横行的地界,为什么康熙会得这个病呢?原来是因为朝廷派兵平定三藩之乱时,八旗兵深入到南方的疟疾疫区,许多人感染了疟疾,回京的时候就把疟原虫也带回来了,先传给了北京的蚊子,随后就在北京城里扩散开了。
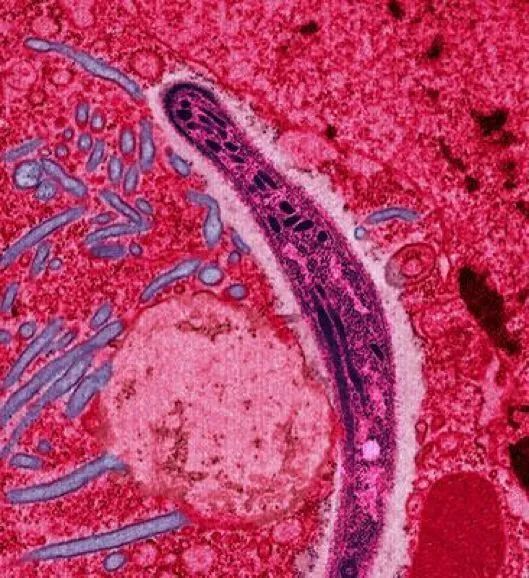 疟原虫从雌蚊唾液移入蚊子细胞 | Wikimedia Commons, Ute Frevert供图, Margaret Shear调色 / CC BY (https://creativecommons.org/licenses/by/2.5)
疟原虫从雌蚊唾液移入蚊子细胞 | Wikimedia Commons, Ute Frevert供图, Margaret Shear调色 / CC BY (https://creativecommons.org/licenses/by/2.5)
中国古代医书上把疟疾称作“瘴气”,以为这种病是由沼泽或者潮湿的丛林中那些有毒的空气造成的。但其实疟疾是由疟原虫引起的, 通过蚊子 (确切来说是雌性按蚊,全世界有 70 多种) 传播 。能够寄生于人体的疟原虫一共 5 种,其中恶性疟原虫 (Plasmodium falciparum) 对人类的威胁最大,因为它可以 引起严重的全身症状,甚至导致死亡 。
疟原虫和其他寄生虫有一个很大的不同,就在于它的宿主之一是蚊子。可不要小看这一点。其他寄生虫普遍遵循的是“人不犯我我不犯人”的原则——比如寄生在鱼体内的肝吸虫,或寄生在猪体内的绦虫,人不去吃,这些寄生虫就不会主动进入人体;但疟原虫不是,它们会通过蚊子主动侵犯人体,人类根本避之不及。
疟疾在民间俗称“打摆子”,之所以这样叫,是因为疟疾在发作的时候,病人起初会感觉非常冷,于是拼命打冷战,全身肌肉持续颤抖几十分钟,之后体温迅速飙升到 40℃以上,就这样持续高烧 2-6 个小时,随后又会突然间大量出汗,并随之退烧。整个发作过程大约要持续 4-12 个小时。但是这可没完,同样的过程在两三天后还会再来一遍,就这样周期性的反复发作。
说回不幸得了疟疾的康熙皇帝。当时的御医们为了给皇上治病绞尽脑汁,把自古以来医书上所有的相关记载都试了个遍 (宫里专门养了一批疟疾病人用来给皇上试药) ,却毫无收效。无奈,只得张榜公告,向全国征集能人良方。这项工作由四位大臣主持,为了保障皇上的安全,所有进献的药品都会先由四位大臣试喝 (相当于临床 I 期实验,验证安全性) ,大臣喝着没有上吐下泻昏迷不醒的话,再把药送给宫里那些疟疾病人去喝 (相当于临床 II 期实验,验证有效性) 。但各种药方试了个遍,还是没有一种有用的。
正当所有人焦头烂额的时候,几位外国传教士入宫觐见,献上了一盒药粉。大臣们对洋人的东西起初非常排斥,但很快就在“临床试验”中发现它效果奇佳。后来,凭着这个药粉,康熙没过多久便彻底康复了。
 电视剧《康熙王朝》中,容妃亲自试药 | 《康熙王朝》截图
电视剧《康熙王朝》中,容妃亲自试药 | 《康熙王朝》截图
这个神奇的药粉就是 奎宁 ,中国人更熟悉的名字叫“金鸡纳霜”——它是世界上第一个治疗疟疾的特效药 (不得不感慨康熙果真是天选之人,天花、疟疾这两种在古代致死率极高的传染病他都得过,居然每一次都大难不死)。
从奎宁到青蒿素
奎宁是 17 世纪初被发现的,最初是用南美的金鸡纳树的树皮磨成的粉。后来,即使科学家分离出了其中的有效成分,但依然难以人工合成,因此金鸡纳树在几百年的时间里都是制造奎宁的唯一原材料。那些拥有金鸡纳树的国家把它们当摇钱树一样严密的保护起来,盗取金鸡纳树的种子就是死罪,还要被施以酷刑。
 金鸡纳树树皮 | Wikimedia Commons, H. Zell / CC BY-SA (https://creativecommons.org/licenses/by-sa/3.0)
金鸡纳树树皮 | Wikimedia Commons, H. Zell / CC BY-SA (https://creativecommons.org/licenses/by-sa/3.0)
不过,奎宁虽然抗疟有功,但它的 副作用也是极大的 。病人服用奎宁后常常出现腹泻、呕吐、耳鸣、耳聋、头痛、视力障碍,有时还会出血、白细胞数量下降,甚至死亡。
而且更严重的问题是,随着奎宁的大范围使用,越来越多的疟原虫 产生了耐药性 。疟疾再次变得难以控制。
二战期间,美国投入巨大的力量研发新的抗疟药物,最终合成出了氯喹。和奎宁相比,氯喹不仅效果更好,而且副作用更小,于是 1947 年以后,氯喹迅速取代奎宁,成为了全世界治疗疟疾的首选药物。
然而仅仅 10 年以后,耐受氯喹的恶性疟原虫就在东南亚出现了。更糟糕的是当时正值越南战争期间,大批“新鲜宿主”被源源不断地输送到潮湿多蚊的丛林沼泽当中,使耐药性恶性疟迅速蔓延。
 仅仅 10 年以后,耐受氯喹的恶性疟原虫就在东南亚出现了 | Pixabay
仅仅 10 年以后,耐受氯喹的恶性疟原虫就在东南亚出现了 | Pixabay
越南人对此无能为力,只好向中国求援。而当时中国自己的疟疾疫情也很严重,药物不足。1967 年,为了彻底扭转这样的被动局面,中国最高领导层拍板,组建了“523项目”,举全国之力,筛选抗疟新药。
最终,1972 年,屠呦呦带领的项目组成功地发现了青蒿素。青蒿素在越战后期投入使用,立刻使得北越的恶性疟病死率下降了30%,对战争的走向起到了深远影响。中国在 1980-1990 年间疟疾病例的大幅下降,也都是青蒿素的功劳。
 屠呦呦发现的青蒿素作为一种用于治疗疟疾的药物,挽救了数百万人的生命 | 图虫创意
屠呦呦发现的青蒿素作为一种用于治疗疟疾的药物,挽救了数百万人的生命 | 图虫创意
至今,以青蒿素为基础的药物联用疗法 (Artemisinin-based combination therapy,ACT) 仍旧是治疗恶性和重症疟疾的一线疗法。然而遗憾的是,几十年下来,新的耐药性疟原虫也逐渐蔓延开来,ACT疗法在东南亚和非洲地区治疗失败的病例越来越多。于是全球科学家又在绞尽脑汁研发新的抗疟药物。
饿死疟原虫
葡萄糖是大多数动物细胞的主要能量来源,如果能够想办法让疟原虫无法摄入葡萄糖,是不是就可以把它们“活活饿死”?这是一个不错的思路。而且,由于葡萄糖分子无法自由通过细胞的生物膜,它们进出细胞都需要依靠细胞膜上的转运蛋白来完成,所以 想要限制疟原虫获取葡萄糖,其实只要控制特定的葡萄糖转运蛋白就可以了 。
针对恶性疟原虫,科学家已经发现, 己糖转运蛋白PfHT1 (Plasmodium falciparum hexose transporter 1) 就是它主要的葡萄糖摄入蛋白,只要抑制这个蛋白的转运活性,就可能让疟原虫因为得不到能量而无法生长和增殖。
但一个众所周知的问题在于,疟原虫是生活在人体细胞中的,而人体细胞也需要葡萄糖,所以怎样才能只饿死疟原虫,而不损害到人体细胞呢?要解决这个难题,就必须充分了解疟原虫的葡萄糖转运蛋白到底是什么结构。可这谈何容易。早期针对 PfHT1 的研究就是困在了这个问题上,研发工作迟迟没能取得突破性进展。
原清华大学生命科学学院和医学院教授、现普林斯顿大学分子生物学系教授颜宁领导的团队一直以来致力于膜转运蛋白的结构解析,并在2014、2015 年相继报道了两种人源葡萄糖转运蛋白GLUT1和GLUT3的高分辨率晶体结构。在此基础上,她开始对 PfHT1 进行结构解析,并与清华大学药学院尹航教授团队合作,进行基于蛋白质结构的小分子药物开发。
通过构象对比,研究团队发现,一个已知的抑制剂可以使PfHT1的蛋白构象发生巨大的变化。在这一发现的基础上,尹航团队开发出了一系列更高效、更有针对性的抑制剂,并在原虫抑制实验中确认可以 有效地杀死疟原虫,却对细胞无害 。这项研究为开发新一代抗疟药物开辟了道路。2020年8月28日,颜宁与尹航团队合作将这项科研成果在线发表于国际顶级期刊《细胞》 (Cell) 上,题为《抑制恶性疟原虫糖摄入的结构基础》 (Structural Basis for Blocking Sugar Uptake into the Malaria Parasite Plasmodium falciparum) 。
 图 | 参考文献[1]
图 | 参考文献[1]
针对疟原虫耐药性不断增加的现状,两个团队还合作提出了新一代小分子抑制剂的设计思路,并通过实验验证了其具有 高杀伤性、低细胞毒性以及针对原虫多个繁殖周期都具有良好抑制效果的多周期性 。这项成果为该系列抗疟药物的进一步开发奠定了基础。研究论文发表在生物领域预印本平台 bioRxiv 上,题为《靶向PfHT1蛋白正构-别构双位点的选择性抗疟药物开发》 (Orthosteric-allosteric dual inhibitors of PfHT1 as selective anti-malarial agents) 。
中国科学院院士、清华大学饶子和教授对此评价说:"研究团队以阻断疟原虫能源摄取为新手段开发的新一代化合物有望解决日趋严重的疟疾耐药性问题;同时靶向膜转运蛋白的正构及别构调节位点的抑制剂设计思路非常具有创造性,也为其他药物理性设计提供了参考。"
此次细胞层面的研究突破,虽然离真正开发出一款全新的抗疟药物还很远,但漫漫征途毕竟迈出了坚实的第一步,我们离成功的曙光已经更近了。
 编辑:袁玥
编辑:袁玥
素材提供&审稿:研究团队
题图来源:图虫创意
参考文献:
[1] Xin Jiang#, Yafei Yuan#, Jian Huang#, Shuo Zhang#, Shuchen Luo, Nan Wang, Debing Pu, Na Zhao, Qingxuan Tang, Kunio Hirata, Xikang Yang, Yaqing Jiao, Tomoyo Sakato-Kato, Jia-Wei Wu, Chuangye Yan, Nobutaka Kato, Hang Yin*, Nieng Yan*. Structural Basis for Blocking Sugar Uptake into the Malaria Parasite Plasmodium falciparum. Cell, 2020, DOI: 10.1016/j.cell.2020.08.015.
[2] Jian Huang#, Yafei Yuan#, Na Zhao#, Debing Pu, Qingxuan Tang, Shuo Zhang, Shuchen Luo, Xikang Yang, Nan Wang, Yu Xiao, Tuan Zhang, Zhuoyi Liu, Tomoyo Sakata-Kato, Xin Jiang*, Nobutaka Kato*, Nieng Yan*, Hang Yin*. Orthosteric-allosteric dual inhibitors of PfHT1 as selective anti-malarial agents. bioRxiv, 2020, DOI: 10.1101/2020.08.25.260232
欢迎个人转发到朋友圈
 本文版权属于“我是科学家”,未经授权不得转载。如需转载请联系iscientist@guokr.com
本文版权属于“我是科学家”,未经授权不得转载。如需转载请联系iscientist@guokr.com
欢迎填写调查问卷,支持我们 ↓↓↓
 “科普中国”公众满意度调查问卷 ▲
“科普中国”公众满意度调查问卷 ▲
【扩展阅读】 这只“嗡嗡”的小虫,竟然是对人类最凶残的杀手



 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国