
|
新冠病毒现有突变并不可怕,但需密切监测新突变科学辟谣 2020-03-10 |
新冠病毒变异后传播能力增强没有充分证据,但变异确实可能影响药物和疫苗研发。
新型冠状病毒(SARS-CoV-2)3D概念图 | Austcham网站
作者 | 汤波 分子生物学博士
近日有报道称,新型冠状病毒(SARS-CoV-2)已发生突变(基因变异),其中一些突变体具有更强的感染能力,引起广泛关注和担忧。不过,根据多项研究显示,这一说法只是基于有限数据的一种推测,缺乏有力证据支撑。
突变优势证据不足
相关报道主要基于2020年3月3日中国科学院《国家科学评论》在线发表的一篇论文,由北京大学生命科学学院陆剑课题组和中国科学院上海巴斯德研究所崔杰课题组合作完成。
研究人员对收录在公共数据库的103个新冠病毒基因组进行分析,从这些基因组中发现了149个突变点,其中同义突变(不改变其所编码的氨基酸)43个,非同义突变(改变其所编码的氨基酸)83个。注:基因组常见碱基有五种:AGCTU(对应嘧啶或嘌呤),三个碱基组成一个密码子,共同编码一个氨基酸。蛋白质由氨基酸组成,因此同义突变一般不影响其所编译蛋白质的结构和功能。例如,CTA与CTG均编码亮氨酸,若A突变为G则该变异为同义突变。
同时研究人员还注意到,新冠病毒基因组的第8782位的T-C突变(同义突变)和第28144位的C-T突变(非同义突变)的两个突变位点高度连锁,即当第8782位碱基为胸腺嘧啶(T)时,第28144位碱基则是胞嘧啶(C),反之当第8782位碱基是胞嘧啶(C)时,第28144位碱基则是胸腺嘧啶(T)。
根据第28144位对应的氨基酸,可将所分析的103个病毒基因组分为L型和S型两种单倍体,其中L型的28144位(碱基T)对应的氨基酸为亮氨酸(L),占比约70%,S型的28144位(碱基C)对应的氨基酸为丝氨酸(S),占比约为28%。通过与其他冠状病毒比较,研究人员发现S型更古老,L型可能是由S型演化而来。
这两种单倍型也存在显著的地区和时间差异。比如来自武汉患者的病毒中,更古老的S型只占3.7%,而L型占到96.3%,这些病毒基因组测序的时间均在1月7日之前;而武汉以外患者的病毒中,S型比例则显著增加,占到38.4%,L型占61.6%,大多数病毒基因组测序时间均在1月7日后。
这表明在早期的传播过程中,作为祖先型的S型几乎完全被L型取代,但随着时间推移,S型的比例又逐渐上升。
研究人员推测,L型可能传播能力更强,复制速度更快,因而在疫情爆发早期会在人群中快速扩张,但不断增强的防控措施对L型不利,所以S型频率逐渐上升。
不过,研究人员最后承认,目前的证据并不能确定,S型和L型是疫情爆发之前在动物宿主中发生分离,还是疫情发生后在人体内发生分离,也不能确定L型是否真比S型更具侵略性,因为目前的推测是基于有限而分散的基因组信息作出的,需要更多更全面的病毒基因组序列信息加以证实。
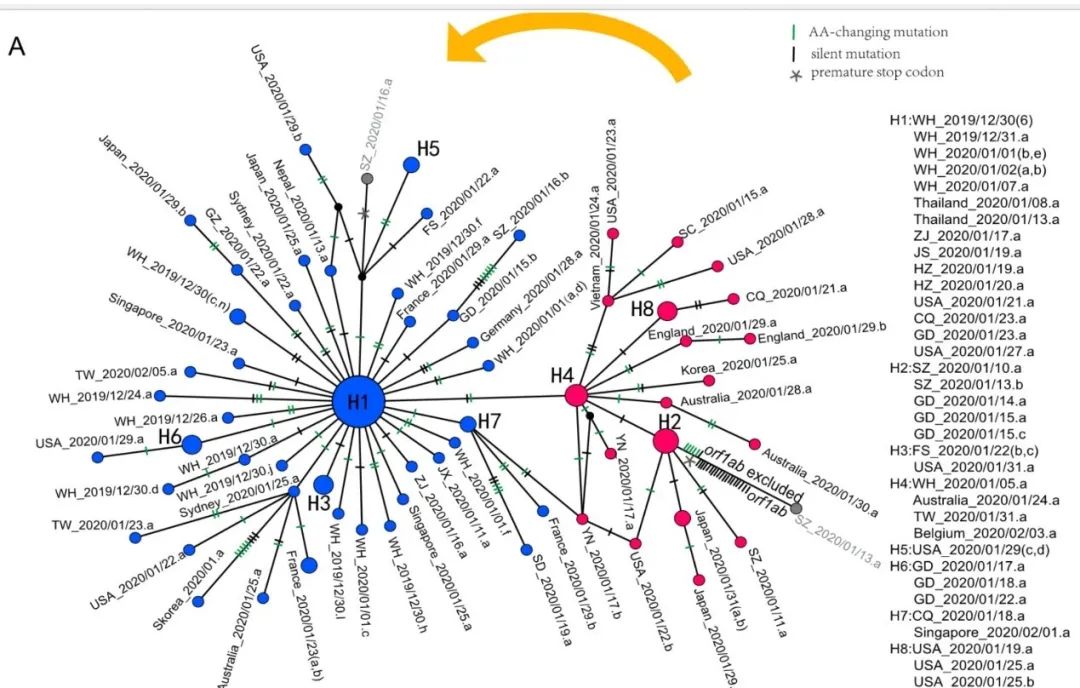
103个新冠病毒(SARS-CoV-2)基因组的分型,蓝色为L型,红色为S型,图中编号表示病毒采集地点和测序时间 | 来自《国家科学评论》
3月2日,中国疾控中心谭文杰和加州大学洛杉矶分校程根宏等团队合作在预印版平台bioRxiv发表文章,也对新冠病毒基因组突变和重组情况进行了分析。
研究人员除了分析公共数据库上的109个新冠病毒基因组之外,还分析了新完成测序的11个病毒基因组信息,他们认为整体突变程度较低,同时也发现了类似突变,并将总共120个新冠病毒分成G1型和G2型,分别对应上一项研究的S型和L型。
谭文杰等人也认为尚不清楚这些突变是发生在疫情爆发之后,还是在动物宿主阶段。另外,G1型和G2型均能在全球范围内快速传播,并不能确定谁更具优势。
这些研究均认为,目前新冠病毒突变率整体偏低,也没有发生重组。目前全球新冠肺炎病例已超过10万,仅凭100多个病毒基因组显然难以真实反映新冠病毒突变的全貌,而且很多国家没有公布相关病毒基因组信息,或者只有少量基因组信息,使得对病毒突变检测结果难以保证准确,因此急需更多国家、更多研究机构共享病毒基因组序列、流行病学数据和临床症状等信息。
3月6日,中国科学院院士周琪在国务院新闻发布会上表示,新冠病毒变异到现在为止有很多报道,但是病毒变异过程需要更多案例,也需要更多深入的研究。目前中国正在积极观测病毒的变异程度,而且积极布局相关科研项目。
病毒突变属正常现象
早在2月18日,耶鲁大学流行病学专家内森·古鲁巴夫(Nathan Grubaugh)等人专门在《自然·微生物》杂志上发表评论文章,指出新冠病毒的突变符合正常流行病学规律,不应该引起恐慌。古鲁巴夫等人指出,RNA病毒发生突变非常高,但是这些病毒在较短的进化时间内发生“改变或扩大传播方式”的突变却是罕见的。
的确,基因突变是物种进化的基本途径,病毒基因突变也不例外。基因突变一般指DNA或RNA在复制过程中单个碱基或少数碱基发生改变。对生物体或病毒来说,基因突变在大多数情况下是不利的,甚至是致命的,只有极少数情况下是有利的。
不同的病毒,基因突变发生率不尽相同。一般RNA病毒的突变率要远高于DNA病毒,比如DNA病毒一个碱基每代平均突变率为一亿分之一到百万分之一,而RNA病毒的突变率为百万分之一到万分之一,相隔两个数量级。其中逆转录病毒(RNA病毒中的一类)突变率最高,如人类免疫缺陷病毒1(HIV-1),平均突变率达到三万分之一。
HIV-1病毒(即1型艾滋病病毒),突变率达到三万分之一,属于RNA病毒中突变率最高的一类(逆转录病毒),该类病毒含有逆转录酶,以RNA指导DNA合成。图为显微图像,遗传物质(RNA)位于球壳内 | www.donjmyers
相对而言,人类细胞DNA的平均突变率仅为一亿分之二点五,与DNA病毒中的最低突变率相当。
如果病毒没有给宿主造成很大伤害,宿主免疫系统也没有给病毒太多压力,病毒与宿主也会相安无事,这时候不同世代病毒的基因组变异通常不会太大。比如蝙蝠与病毒的关系就比较“和谐”。
蝙蝠是自然界的超级病毒库,可携带上百种病毒,冠状病毒、埃博拉病毒、狂犬病病毒等人类致命病毒,都起源于蝙蝠,但是蝙蝠却安然无恙。皆因为它的免疫系统比较不敏感,对病毒睁一只眼闭一只眼。
如果宿主细胞免疫系统比较厉害,或者得到一些抗病毒药物或疫苗的协助,病毒面临较大的生存压力,则较有可能表现出进化的一面。因为拥有一些特殊基因突变的病毒可能在其中显示出竞争优势,比如表现出对药物和疫苗的抵抗力、逃避宿主免疫系统攻击、增强对宿主细胞的感染能力、适应新的组织器官甚至新的宿主等,得以在新的环境或压力中存活下去。
有研究表明,人类免疫缺陷病毒1(HIV-1)Gag蛋白(一种重要的结构蛋白)中第30位氨基酸发生突变,使得原本只感染黑猩猩的猿猴免疫缺陷病毒(SIV)具备了较强的感染人类的能力,而埃博拉病毒中的单个突变GP-A82V,同样增加了对人类细胞的感染能力。
不过,这只是部分情况。2003年爆发的SARS冠状病毒与新冠病毒同属一个病毒物种,同样被检测出110多个基因突变,但并没有发生增强感染能力和传染能力的突变。
可能对疫苗和药物研发不利
依靠基因突变产生对病毒有益的变异是个长期积累的过程,在短时间内很难获得有益突变,不过长期来看,新的基因突变可能影响疫苗和抗病毒药物的疗效,值得密切监测和关注。
比如,在HIV病毒、流感病毒、乙肝病毒和丙肝病毒等很多病毒中,都能观察到频繁的基因突变,有时候一个碱基的点突变就可能击败人类花数年时间研发出的疫苗或药物。
美国斯克里普斯研究所研究人员就曾发现,在鸡胚中生长的流感病毒发生了一个氨基酸突变,导致用鸡胚生产的疫苗保护率大幅降低。
流感疫苗通常是用鸡胚生产的,大概流程是:将致病的流感病毒接种到无菌培养的鸡胚中,然后收集在鸡胚中大量增殖的流感病毒进行灭活处理,制备出灭活或减毒疫苗。
一般流感疫苗的保护率约为50~70%,但是针对H3N2毒株的流感疫苗保护率仅为33%。研究人员仔细分析了在鸡胚中传代的H3N2毒株的基因组序列,发现该毒株血凝素糖蛋白上的第194位氨基酸发生了突变,由亮氨酸变成了脯氨酸。H3N2毒株正是因为这个突变得以适应在鸡胚中快速生长,最终导致利用这一毒株生产的流感疫苗保护率非常低。

毒株变异可能导致制备疫苗的保护率变低,图文无关 | 图虫创意
药物方面也一样。经过30多年努力,尽管艾滋病毒(HIV)疫苗仍然没有获得成功,但是抗HIV病毒药物则取得了不错成效。目前全世界已批准40多种抗病毒药物用于艾滋病治疗,特别是混合多种抗病毒药物的“鸡尾酒疗法”疗效显著。
虽然不能完全根除患者体内的艾滋病病毒,但是这些抗病毒药物可将病毒载量控制在极低水平,使得患者的身体状况和预期寿命大幅提升。据联合国数据,2018年全世界共有3790万艾滋病患者,其中2300万人接受了抗病毒药物治疗。
不过随着抗病毒药物的广泛应用,艾滋病病毒也不断产生可抵抗某些抗病毒药物的突变,导致药物失效。目前,约有5~15%的新确诊患者和10~25%的急性感染患者均表现出不同程度的抗药性,已记录在册的抗药性突变超过200种。
当然,病毒突变也不全对病毒自身有利,美国密苏里大学医学院和日本国家健康与医学研究中心等机构的研究人员就发现,有一个艾滋病患者身上的HIV病毒存在一个点突变,竟然能降低病毒对抗HIV药物的耐药性。这也提示科学家,及时监测致命病毒的基因突变,既可准确查明药物失效、免疫失败和疫情爆发的原因,也可能有助于找到对抗病毒的有效方法。
(责编 高佩雯)
参考文献
Xiaolu Tang, Changcheng Wu, Xiang Li, et al. On the origin and continuingevolution of SARS-CoV-2. National Science Review, nwaa036, https://doi.org/10.1093/nsr/nwaa036.
Aiping Wu, Peihua Niu, LulanWang, et al. Mutations, Recombination and Insertion in the Evolution of2019-nCoV. bioRxiv 2020.02.29.971101; doi: https://doi.org/10.1101/2020.02.29.971101.
Grubaugh, N.D., Petrone, M.E. & Holmes, E.C. We shouldn’t worry whena virus mutates during disease outbreaks. Nat Microbiol (2020).https://doi.org/10.1038/s41564-020-0690-4.
Arthur Villasanta. Coronavirus MutationConfirmed: Scientists Found Two Types Of COVID-19 Infecting World. https://www.ibtimes.com/coronavirus-mutation-confirmed-scientists-found-two-types-covid-19-infecting-world-2934239
SethJ. Zost, Kaela Parkhouse, Megan E. Gumina, et al.. Contemporary H3N2 influenzaviruses have a glycosylation site that alters binding of antibodies elicited byegg-adapted vaccine strains. Proceedings of the National Academy of Sciences,2017; 201712377 DOI: 10.1073/pnas.1712377114.
责任编辑:王超
上一篇:疫情期间,牙齿不舒服怎么办?
 科普中国APP
科普中国APP
 科普中国微信
科普中国微信
 科普中国微博
科普中国微博

最新文章
-
为何太阳系所有行星都在同一平面上旋转?
新浪科技 2021-09-29
-
我国学者揭示早期宇宙星际间重元素起源之谜
中国科学报 2021-09-29
-
比“胖五”更能扛!我国新一代载人运载火箭要来了
科技日报 2021-09-29
-
5G演进已开始,6G研究正进行
光明日报 2021-09-28
-
“早期暗能量”或让宇宙年轻10亿岁
科技日报 2021-09-28
-
5G、大数据、人工智能,看看现代交通的创新元素
新华网 2021-09-28













微信扫一扫:分享
微信里点“发现”,扫一下
二维码便可将本文分享至朋友圈。