出品:科普中国
制作:夏至(关西科健产业研究院)
监制:中国科学院计算机网络信息中心
本周又有一株大肠杆菌登上了科学界的巅峰《自然》杂志,号称人类历史上第一个全基因组被改写的人工合成微生物。虽然“基因组改写”和“人工合成”这样的名词在人造生命研究领域已经不算是新鲜说法了,这株人造大肠杆菌还是登上了各国科技媒体的头条。它到底有什么特殊之处,能够称得上历史第一呢?
通俗地说,研究者们对大肠杆菌的整套DNA中的一些编码进行了同义替换,然后从头合成了这套“全新”的基因组,造出了这株叫做Syn61的人造大肠杆菌。由此可见,全基因组改写确实没错,但并非是完全改写,相当于一部书稿中对某几个词汇进行了同义替换。即便是这样,这一成就也堪称是人造生命研究史上的里程碑事件。那么,人造生命研究领域近年来发生了哪些大事件?它们与这次的成果相比有哪些异同之处?进行人造生命研究到底有什么现实意义呢?
人造生命近年来的重大进展
人类历史上首个合成生命的名号属于2010年诞生的一个衣原体。当时的科研团队参照自然存在的衣原体,人工合成了未经改动的大小约有1Mb的衣原体基因组,造出了第一个人工合成的微生物。
2018年中国制造的单染色体酵母,则是将酵母的多条染色体首尾相接,没有对基因组进行大范围的改写,DNA也不是人工合成(酵母属于真核生物,基因组有12Mb之大,远远超过衣原体),但毕竟是创造了自然界中不存在的物种,也算得上是第一个人造真核生物。
今年2月,日美科学家在《科学》杂志上发表论文,介绍了它们最新合成的8碱基DNA。我们在高中已经学过DNA是由ATGC四个碱基排列构成的,而8碱基DNA则是在通常四个碱基基础上,又添加了SBPZ四个新碱基,合成了一段含有8种碱基的DNA。8碱基DNA可以说是目前人造生命研究领域中最为“人造”的一项重大成果,因为SBPZ四个新碱基在自然界中根本不存在。可惜的是,这项成就在推广方面没有达到本身应有的高度,知名度不及其它几项研究。
与这些历史上的“第一”做个对比,就知道Syn61为何称得上是第一个全基因组被改写的人工合成微生物了(具有8碱基DNA的微生物目前还未被制造出来)。Syn61是在一株经过冗余基因删除的大肠杆菌MDS42的基础上进行改写的。此前,其他科学团队只做到了在大肠杆菌的全基因组中替换一个终止信号(且其DNA并非全人工合成),或者在一段基因中进行部分替换。
对遗传语言的同义替换是如何做到的?
要搞清楚这个问题,先来复习一下生物的遗传密码DNA。
高中生物课告诉我们,地球上的一切生物,包括我们自身、我们的宠物、我们的食物和我们身上和体内的细菌等等,遗传信息均由细胞核内染色体上称为DNA(脱氧核糖核酸)的大分子所保存(部分病毒为RNA,即核糖核酸)。而DNA是用一套遗传语言编码而成的,且这套语言中只含有ATGC四个字母,A与T、G与C两两配对(在RNA中是AUGC,U代替DNA中的T,与A配对)。这四个字母代表的四种碱基排列构成了我们的DNA,一段段记录了遗传信息的DNA就是基因。

DNA和RNA的结构对比,作者见图
在读取基因记录的信息时,相邻的三个碱基为一组,4种碱基可能出现的排列组合就有64种,这样的排列组合就是密码子。每种密码子可以对应一种氨基酸或者终止信号,64种密码子对应了参与合成蛋白质的20种氨基酸和3个终止信号。
在制造蛋白质时,DNA的序列首先被转录到信使RNA中,蛋白质制造工厂——核糖体则以信使RNA为模板,读取三个碱基一组的遗传信息,将一个个氨基酸连成一串,最终合成生命的基础——蛋白质。只有4个字母的DNA中就是这样携带了大量信息,再通过精巧的过程被解读,使我们和宠物、食物、细菌的区别一目了然。
如下图所示,信使RNA携带从DNA处转录而来的遗传信息密码子进入核糖体,转移RNA携带氨基酸前来与之配对,把密码子片段表示的氨基酸装配成蛋白质。好比是串珠一般,信使RNA按照DNA的指示,决定了每颗珠子安放的位置,核糖体负责进行串珠操作,转移RNA负责把五颜六色的各色珠子搬运到作业场所,拼合而成的珠串就是新合成的蛋白质。

蛋白质合成过程,公有领域
然而,20种氨基酸对应的密码子却有61个, 终止信号还有3个,这样就会产生多种密码子对应同一种氨基酸的“冗余”情况。事实上,对应同一种氨基酸的不同密码子(被称为同义密码子)的效果并不是完全相同。在不同的物种中、不同的情况下,有一些密码子的使用会多于另一些密码子,这种现象叫做密码子偏好,而即便是同义密码子之间的替换也会改变蛋白质的表达情况。
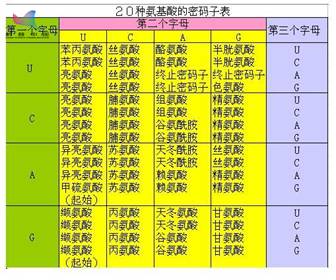
构成人体20种氨基酸的密码子表,图中U即代表DNA中的T,作者供图
大肠杆菌Syn61的重大意义在哪里?
正常情况下,生物体中编码蛋白质的密码子即便存在“密码子偏好”,也不会出现某种密码子完全不会出现的情况。那么问题就来了,是不是每一种密码子都不可或缺?如果某几种密码子完全不出现在基因组中,生命体还能维持基础功能吗?
Syn61的重大意义就在于此。此次研究中,科学家们将两个编码丝氨酸的密码子TCG和TCA分别用AGC和AGT进行替换(这四个组合都能编码丝氨酸,参见上图),将终止密码子TAG替换成TAA,最终编写了Syn61的基因组。Syn61即意为合成的、有61个密码子(59个氨基酸密码子+2个终止密码子,正常情况是61个氨基酸密码子和3个终止密码子)。
这株“人工致残”的大肠杆菌Syn61也确实与改编之前的祖先MDS42有些许不同:Syn61菌体的长度要略长于MDS42;在37℃下,Syn61比MDS42的复制速度要慢1.6倍。可见,即便是编码同一个氨基酸,不同的密码子对基因表达的影响也是不可估量的。要知道在这项研究中,科学家们在改编密码子的时候已经非常小心翼翼了。考虑到DNA中G和C两种碱基的含量会影响DNA的性质,科学家选用了尽可能不改变G、C含量的改写方法。
除了形态和生长速度方面的改变,删除特定密码子也给Syn61带来了特殊的性质。首先,一种针对TCG密码子的毒性物质对于Syn61来说毫无杀伤力。另外,对于普通大肠杆菌来说不可缺少的、TCA密码子必需的物质,对于Syn61来说也可有可无。
那么,腾出来的三个密码子又有什么用?简单来说,如果细菌不需要这三个密码子,我们就可以让这些密码子携带其他的信息,比如对应一种现有蛋白质中20种氨基酸之外的氨基酸,赋予大肠杆菌一些人类所需要的功能。当然,要做到这一步除了“密码”要换,相应的“解码器”也要换,这项技术离具体应用还非常遥远。
密码子不够用,为什么不增加碱基呢!
4种碱基最多只能组合出64种密码子,除去细菌必需的密码子,我们能够利用的极其有限。另外一群美国科学家并没有将思维局限于此,他们的思路是,增加碱基数量,这样密码子想要多少就有多少,这就是我们文章第一部分提到过的8碱基DNA。
这项新鲜出炉的研究发表在今年2月份的《科学》杂志上。在通常的ATGC之外,他们模仿现有碱基的结构创造了SBPZ四个新碱基,合成了一段含有8个碱基的DNA。文章的第一作者是一位日籍科学家,这个自豪的日本人和他慷慨的美国老板将这种8碱基的核酸命名为“Hachimoji”,即为日语“八文字”的发音。8碱基DNA中S和B配对,P和Z配对,无论新碱基如何排列,三维结构都可以完全维持4碱基DNA的原状,保证了8碱基DNA的稳定存在和后续功能的执行。与之前或无法自然配对或无法维持DNA结构的人工合成碱基相比,8碱基DNA绝对称得上是一项里程碑式的发明。
当然这个团队并没有满足于此,考虑到DNA只有将信息传达出去才能实现其价值,他们通过改造现有的RNA聚合酶,找到了可以将8碱基DNA转录成RNA 的那一个。SBPZ 四个新碱基都有对应的RNA版本,因此新合成的8碱基DNA可以无障碍地转录成RNA,并有望继续执行功能。当然,8碱基DNA和RNA的合成距离其成为真正的遗传系统(至少需要能够指导蛋白质的合成)还有很长的路要走,但是这条路终点的生物体,就是从各种意义上来讲都当之无愧的人工合成生命。
人工合成的碱基到底有什么应用价值?
正如前面所说,新的碱基可以帮助科学家利用新的氨基酸合成自然界中不存在的蛋白质,8种碱基就相当于有了512种密码子。除此之外,创造8碱基DNA的团队曾经发现,他们合成的含有碱基Z和P的DNA能够更好地和癌细胞结合。利用这项特性,人工合成DNA就可以在癌症的诊断、药物定向导入等等方面发挥巨大作用。
如何用几句话把上面的所有技术都归纳出来?
举个可能有些不太准确的例子,遗传信息好比是我们手中的一份文稿,有几十页。本来它们都按着页码叠在一起,但是你要是把它们一页一页首尾相接粘起来,这就和中国的单染色体酵母类似了。如果你把文稿中的一些词汇全部替换为另外的说法,那就和这次的全基因组改写大肠杆菌类似了。如果你在文稿中加入了另外一套之前谁都没有见过的文字,这就是8碱基DNA的情形,并且,由于你加入了全新的文字,很多其它的文稿处理软件很可能没法正确识别你的文档,这就是所谓的8碱基DNA还需要与之相应的技术支持才能真正发挥效用。
参考文献:
1. https://www.nature.com/articles/s41586-019-1192-5
2. https://science.sciencemag.org/content/312/5776/1044
3. https://www.statnews.com/2019/05/15/recoded-bacteria-genome-made-from-scratch/
4. https://science.sciencemag.org/content/363/6429/884
5. https://www.nature.com/articles/d41586-019-00650-8

 科普中国APP
科普中国APP
 科普中国微信
科普中国微信
 科普中国微博
科普中国微博