发现
1826年H·dela比拉迪埃用含有淀粉(指示剂)、氯化钠和碳酸氢钠的碘化物溶液为滴定剂,滴定次氯酸钠溶液(漂白液),1840年有人以淀粉为指示剂,用碘的乙醇溶液为滴定剂,滴定硫化物溶液以后,碘量法应用日益广泛。
定义碘量法是氧化还原滴定法中,应用比较广泛的一种方法。这是因为电对I2-I-的标准电位既不高,也不低,碘可做为氧化剂而被中强的还原剂(如Sn2+,H2S)等所还原;碘离子也可做为还原剂而被中强的或强的氧化剂(如H2SO4,IO3-,Cr2O72-,MnO4-等)所氧化。
碘量法以碘作为氧化剂,或以碘化物(如碘化钾)作为还原剂进行滴定的方法。
方法概要原理:碘量法是利用的I2氧化性和 I-的还原性为基础的一种氧化还原方法。
基本半反应:I2 + 2e = 2 I-
I2 的 S 小:20 ℃为 1.33×10-3 mol/L
而I2 (水合) + I-=I3- (配位离子) K = 710
过量I-存在时半反应。
极微量的碘与多羟基化合物淀粉相遇,也能立即形成深蓝色的配合物,碘的这一性质是使碘量法得到应用。
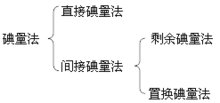
滴定原理直接碘量法直接碘量法是用碘滴定液直接滴定还原性物质的方法。在滴定过程中,I2被还原为I:
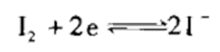
滴定条件:弱酸(HAc ,pH =5 )弱碱(Na2CO3,pH =8)溶液中进行;如果溶液pH>9,可发生副反应使测定结果不准确。
强酸中: 4I-+ O2(空气中) + 4H+= 2I2+ H2O
强碱中: 3I2+ 6OH-=IO3-+ 5I-+ 3H2O
指示剂:1)淀粉,淀粉遇碘显蓝色,反应极为灵敏。化学计量点稍后,溶液中有过量的碘,碘与淀粉结合显蓝色而指示终点到达。2)碘自身的颜色指示终点,化学计量点后,溶液中稍过量的碘显黄色而指示终点。
可滴定物:I2 是较弱的氧化剂,凡是E0’( E0 )
S2-、S2O32-、SO32-、As2O3、Vc等
间接碘量法1)剩余碘量法
剩余碘量法是在供试品(还原性物质)溶液中先加入定量、过量的碘滴定液,待I2与测定组分反应完全后,然后用硫代硫酸钠滴定液滴定剩余的碘,以求出待测组分含量的方法。滴定反应为:

2)置换碘量法
置换碘量法是先在供试品(氧化性物质)溶液中加入碘化钾,供试品将碘化钾氧化析出定量的碘,碘再用硫代硫酸钠滴定液滴定,从而可求出待测组分含量。滴定反应为:
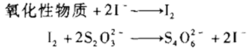
间接碘量法:
指示剂:淀粉,淀粉指示剂应在近终点时加入,因为当溶液中有大量碘存在时,碘易吸附在淀粉表面,影响终点的正确判断。
滴定条件:在一定条件下,用I-还原氧化性物质,然后用 Na2S2O3标准溶液滴定析出的碘。(此法也可用来测定还原性物质和能与 CrO42- 定量生成沉淀的离子)
间接碘量法的反应条件和滴定条件:
①酸度的影响—— I2 与Na2S2O3应在中性、弱酸性溶液中进行反应。
若在碱性溶液中:S2O32-+ 4I2 + 10 OH-= 2SO42-+ 8I- + 5H2O
3I2 + 6OH-=IO3-+ 5I- + 3H2O
若在酸性溶液中:S2O32-+ 2H+= 2SO2 + Sˉ+ H2O
4I- + O2 (空气中) + 4H+= 2I2 + H2O
②防止 I2 挥发
i ) 加入过量KI(比理论值大2~3倍)与 I2 生成I3-,减少 I2挥发;
ii ) 室温下进行;
iii) 滴定时不要剧烈摇动。
③防止I- 被氧化
i) 避免光照——日光有催化作用;
ii) 析出 I2后不要放置过久(一般暗处5 ~ 7min );
iii) 滴定速度适当快。
可滴定物:I-是中等强度的还原剂。主要用来测定:E0’( E0 ) 9时,I2易发生歧化反应,生成IO、IO3, 而IO、IO3不与淀粉发生显色反应,当pH




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国